Полимеразная цепная реакция (ПЦР) – это мощный инструмент молекулярной биологии, который позволяет копировать и анализировать конкретные участки ДНК. Важной областью применения ПЦР является диагностика инфекционных заболеваний, включая коронавирусную инфекцию. Однако, чтобы получить достоверные результаты ПЦР-теста, важно знать эффективные методы и последовательность действий.
Первым шагом для ПЦР-тестирования является сбор проб. Обычно для определения коронавируса используется секрет носа и глотки, но также могут использоваться и другие материалы, такие как слюна или кровь. Важно правильно собирать пробы, чтобы увеличить вероятность получения точного результата ПЦР-анализа.
Далее следует обработка собранных проб в лаборатории. Этот процесс включает шаги, такие как экстракция ДНК, добавление необходимых реагентов и нагревание смеси. Важно следовать всем этапам обработки проб, чтобы избежать ошибок или искажений результатов анализа.
После обработки проб происходит сама ПЦР. Этот процесс включает циклы разогрева и охлаждения, которые позволяют разделить две нити ДНК, присоединить праймеры и фермент полимеразы, а затем продублировать целевой участок ДНК. Важно обратить внимание на длительность и температуру каждого цикла ПЦР, чтобы получить надежные результаты анализа.
Наконец, полученные продукты ПЦР подвергаются анализу и интерпретации результатов. Для этого можно использовать различные методы, включая электрофорез, флуоресцентную маркировку или секвенирование. Важно проанализировать полученные данные с помощью специального программного обеспечения и сравнить их с базой данных для точного определения наличия или отсутствия инфекции.
Весь процесс ПЦР-тестирования, начиная с сбора проб и заканчивая анализом результатов, требует строгое соблюдение протоколов и руководств. Это помогает минимизировать возможность ошибок и обеспечивает точность ПЦР-анализа. Команда специалистов в лабораториях по диагностике инфекций постоянно совершенствуют методы ПЦР для высокой эффективности и надежности результатов.
Методы определения эффективности ПЦР
Один из таких методов - анализ амплифицированной ДНК с использованием электрофореза. После проведения ПЦР, амплифицированную ДНК можно разделить на фрагменты разной длины с использованием электрофореза. Анализ этих фрагментов позволяет определить эффективность ПЦР, исходя из количества и интенсивности амплифицированных фрагментов.
Другой метод - количественное определение амплифицированной ДНК с помощью реального времени ПЦР (qPCR). Этот метод позволяет не только определить эффективность ПЦР, но и точно измерить количество амплифицированной ДНК в реальном времени. qPCR особенно полезен, когда требуется точное определение количества ампликонов в реакции.
Также существует метод определения эффективности ПЦР с использованием гелевой электрофорезы. Для этого амплифицированная ДНК разделяется по размеру на геле и затем визуализируется при помощи ДНК-связывающих красителей или специфических проб.
Кроме того, для оценки эффективности ПЦР могут использоваться качественные методы, такие как секвенирование ДНК. После амплификации и разделения на геле, фрагменты ДНК могут быть отправлены на секвенирование, чтобы подтвердить их точность и идентифицировать присутствие каких-либо мутаций или генетических вариантов.
| Метод | Преимущества | Недостатки |
|---|---|---|
| Анализ электрофорезом | Прост в использовании, доступный | Не всегда точное определение количества амплифицированной ДНК |
| qPCR | Точное количественное измерение, реальное время | Высокая стоимость оборудования |
| Гелевая электрофореза | Прост в использовании, доступный | Не всегда точное определение количества амплифицированной ДНК |
| Секвенирование ДНК | Подтверждение точности, идентификация мутаций | Дорогостоящий метод |
Каждый из этих методов имеет свои преимущества и недостатки, и выбор определенного метода зависит от конкретных требований исследования. Различные методы могут быть комбинированы для достижения наибольшей точности и эффективности при определении результатов ПЦР.
Критерии эффективности ПЦР
Вот некоторые критерии, которые можно использовать для оценки эффективности ПЦР:
| Критерий | Описание |
|---|---|
| Чувствительность | ПЦР должна быть достаточно чувствительной, чтобы обнаруживать низкие концентрации ДНК. Это означает, что даже незначительные изменения концентрации ДНК можно обнаружить с высокой точностью. |
| Специфичность | ПЦР должна быть специфичной, то есть способной различать один ген или ДНК-фрагмент от других. Это важно для предотвращения ложноположительных или ложноотрицательных результатов. |
| Эффективность умножения | ПЦР должна обеспечивать высокую эффективность умножения ДНК, чтобы достичь достаточно высокой концентрации амплифицированного материала для дальнейших анализов. |
| Воспроизводимость | ПЦР должна быть воспроизводимой, чтобы результаты можно было повторить в разных лабораториях и в разное время. |
| Надежность | ПЦР должна быть надежной, чтобы минимизировать возможность ошибок и искажений результатов. |
Оценка чувствительности ПЦР

Коэффициент чувствительности ПЦР определяется различными факторами. Один из ключевых факторов - правильный подбор праймеров, которые используются в реакции. Праймеры должны быть специфическими к целевой ДНК и обеспечивать эффективное удлинение целевого фрагмента ДНК при каждом цикле ПЦР.
Важно также обратить внимание на оптимизацию реакционных условий, таких как температура, время удлиннения и концентрация компонентов реакции. Небольшие изменения в этих параметрах могут значительно повлиять на чувствительность ПЦР.
| Фактор | Влияние на чувствительность ПЦР |
|---|---|
| Праймеры | Правильный подбор праймеров обеспечивает высокую чувствительность ПЦР. Неспецифические праймеры могут приводить к ложноотрицательным результатам. |
| Реакционные условия | Оптимальные температура и время удлиннения, а также правильная концентрация компонентов реакции существенно влияют на чувствительность ПЦР. |
| Контрольные образцы | Включение положительного и отрицательного контроля в реакцию помогает оценить чувствительность ПЦР и исключить ложноотрицательные и ложноположительные результаты. |
Для оценки чувствительности ПЦР часто используются серии дилуций образцов с известной концентрацией целевой ДНК. При этом выполняют несколько параллельных реакций, изменяя концентрацию ДНК образца. Затем анализируют полученные результаты и определяют минимально обнаруживаемую концентрацию ДНК.
Оценка чувствительности ПЦР является важным этапом при разработке и валидации методов диагностики, и позволяет определить границы применимости ПЦР для конкретной задачи.
Оценка специфичности ПЦР
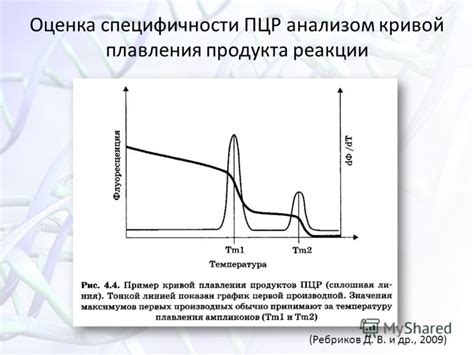
Существует несколько способов оценки специфичности ПЦР:
- Последовательностный анализ: после проведения ПЦР продукт амплификации может быть подвергнут секвенированию. Затем полученные последовательности сравниваются с известными последовательностями генов или ДНК-фрагментов в базах данных. Если последовательность совпадает только с целевым геном или фрагментом, то это говорит о высокой специфичности ПЦР.
- Гелевая электрофорез: после проведения ПЦР продукт амплификации может быть разделен на отдельные фрагменты с помощью гелевой электрофореза. Затем гель окрашивается специфическими красителями, которые связываются только с целевым геном или фрагментом. Если на геле обнаруживается только одна полоса, то это говорит о высокой специфичности ПЦР.
- Количественный анализ: с использованием специальной методики, например реального времени ПЦР или пиролиза, можно определить количество амплифицированных молекул. Если в реакции присутствует только целевой ген или фрагмент, то количество амплифицированных молекул будет соответствовать ожидаемым значениям. Это также свидетельствует о высокой специфичности ПЦР.
Оценка специфичности ПЦР важна для исключения ложноположительных результатов и обеспечения надежности полученных данных. Правильный выбор метода оценки специфичности зависит от задачи исследования, доступных ресурсов и времени.
Сравнение эффективности различных методов ПЦР
Одним из наиболее распространенных методов ПЦР является обычная ПЦР, которая основана на трех шагах: денатурации, отжиге и продление. Часто используется в исследованиях генетических отклонений, выявлении инфекций и идентификации генетических факторов, связанных с заболеваниями.
Следующий метод - квантитативная ПЦР (qPCR), который позволяет количественно измерять количество конкретной ДНК или РНК в образце. Он основан на обычной ПЦР, но с использованием флуоресцентных проб и детектировании количества флуоресценции после каждого цикла амплификации. Этот метод широко применяется в клинической диагностике и исследованиях экспрессии генов.
Другим вариантом ПЦР является реверс-транскрипционная ПЦР (RT-PCR), которая позволяет изучать экспрессию генов на уровне РНК. Он включает преобразование РНК в комплементарную ДНК (cDNA) с помощью обратной транскрипции и последующую амплификацию cDNA с использованием обычной ПЦР. Этот метод широко используется в исследованиях генной экспрессии и диагностике инфекций.
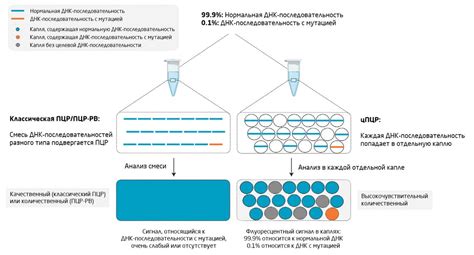
Наконец, существует метод цифровой ПЦР (dPCR), который позволяет абсолютно количественное измерение целевой ДНК или РНК без использования стандартных калибровочных кривых. Вместо этого, образец разделяется на множество малых реакций, где каждая реакция содержит либо одну, либо ни одной молекулы целевой ДНК или РНК. Дополнительно используются флуоресцентные пробы для определения наличия или отсутствия целевых молекул в каждой реакции.
Организация, выбор и оптимизация метода ПЦР зависит от множества факторов, включая конкретные цели исследования, доступные ресурсы и тип образца. При выборе метода ПЦР важно учитывать его эффективность, точность и возможности дальнейшего анализа полученных результатов.
Рекомендации по проведению ПЦР

- Безопасность: при проведении ПЦР следует соблюдать меры предосторожности, связанные с работой с генетическим материалом. Носить защитные очки, перчатки и другие средства индивидуальной защиты.
- Чистота: рабочая область должна быть чистой и свободной от контаминации. Регулярно дезинфицируйте рабочую поверхность и используйте стерильные пластиковые принадлежности для выполнения всех операций.
- Контрольные пробы: включите в каждый эксперимент контрольные пробы, чтобы проверить правильность проведения ПЦР. Негативная и позитивная контрольные пробы помогут исключить возможные ошибки или загрязнения.
- Разделение областей: физически разделяйте препарирование образцов, добавление шаблона ДНК и амплификацию продукта ПЦР в отдельных помещениях или с различными наборами пипеток и принадлежностей, чтобы предотвратить контаминацию.
- Позитивный контроль: используйте позитивный контроль, чтобы проверить работоспособность всех компонентов ПЦР. Это поможет выявить проблемы с реакцией или компонентами реагентов.
- Температурный контроль: следите за температурными условиями во время проведения ПЦР. Установите правильные температуры для денатурации, отжига и продления.
- Компоненты: используйте только качественные и проверенные компоненты для проведения ПЦР. Низкокачественные или просроченные реагенты могут повлиять на результаты.
- Коммуникация: общайтесь с коллегами и специалистами, получайте советы и предложения. Делитесь своим опытом и участвуйте в конференциях и семинарах, чтобы улучшить свои навыки и знания.
Соблюдение этих рекомендаций поможет обеспечить надежность и точность результатов ПЦР, что является особенно важным для клинической диагностики и научных исследований.
Важность правильной выборки для эффективной ПЦР
Результаты ПЦР могут быть искажены или сделать недостоверными по многим причинам, включая неправильную взаимодействие компонентов ПЦР-смеси, наличие ингибиторов реакции или присутствие контаминации в образце. Правильный выбор образцов - это первый шаг для достижения точности и эффективности ПЦР.
Важно обратить внимание на следующие аспекты при выборе образцов для ПЦР:
- Качество образца: Образец должен быть чистым и не содержать ингибиторов, которые могут помешать проведению реакции. При подготовке образца необходимо избегать контаминации, особенно ДНК или РНК чужеродного происхождения.
- Надежность образца: Образец должен быть достаточного объема и содержать достаточно ДНК или РНК для уверенной проведения ПЦР. Недостаточное содержание материала может привести к ошибкам или ложноотрицательным результатам.
- Правильная маркировка образца: Для предотвращения путаницы и неправильных результатов, необходимо правильно и четко пометить каждый образец. Это позволит точно определить, какой образец был использован для проведения ПЦР.
При подготовке и выборе образцов для ПЦР необходимо соблюдать все указанные выше аспекты, чтобы получить эффективные и достоверные результаты. Неправильная выборка или подготовка образцов может привести к потере времени и финансовых ресурсов, а также к неправильной интерпретации данных и неправильным диагнозам.
Контрольные мероприятия при проведении ПЦР

Для обеспечения точности и надежности результатов ПЦР (полимеразной цепной реакции) необходимо проводить контрольные мероприятия. Они помогают исключить возможность ошибок и дать достоверные данные.
1. Положительный и отрицательный контроль
При каждом проведении ПЦР следует использовать положительный и отрицательный контрольные пробы. Положительная проба должна содержать известное количество целевой ДНК, чтобы удостовериться в работоспособности реакции. Отрицательная проба должна быть без ДНК или содержать ДНК, несущую другую целевую последовательность, которая не должна быть обнаружена в результате.
2. Контрольные пробы амплификации
Также рекомендуется включать в каждую реакцию контрольные пробы амплификации. К ним относятся пробы, содержащие известное количество ДНК, обнаружение которой гарантирует, что амплификация прошла успешно.
3. Контрольные пробы изоляции ДНК
Для исключения возможности контаминации проб нужно проводить контрольные пробы изоляции ДНК. Это поможет удостовериться, что используемые пробы не содержат посторонней ДНК, которая может исказить результаты.
4. Мониторинг чистоты реактивов и рабочей области
Регулярный мониторинг чистоты реактивов и рабочей области помогает предотвратить возможность контаминации ДНК извне. Необходимо проводить тесты на поконтрольной ДНК, чтобы исключить наличие ДНК, которая не была добавлена намеренно.