Уравнение состояния идеального газа является основополагающим понятием в физике и химии. Оно описывает математическую связь между такими параметрами, как давление, объем и температура идеального газа. Величины, в которых измеряются эти параметры, имеют важное значение для понимания и применения уравнения состояния идеального газа.
Главной величиной, в которой измеряется давление идеального газа, является паскаль (Па). Однако часто также используют миллиметры ртутного столба (мм рт. ст.), бары (бар) или атмосферы (атм), особенно в бытовых условиях или в гидравлических системах.
Объем идеального газа измеряется в кубических метрах (м³). Это единица объема, которая позволяет определить, сколько пространства занимает газ.
Температура идеального газа измеряется в градусах Цельсия (°C) или кельвинах (K). Кельвин – это международная система измерения температуры, которая отражает количественные изменения в тепловом движении молекул газа.
Давление как физическая величина
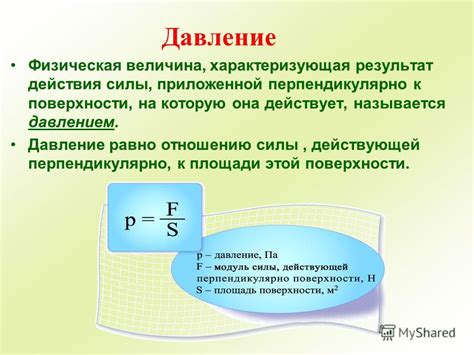
Давление представляет собой силу, действующую на единицу площади. Формально, давление определяется как отношение силы, действующей перпендикулярно поверхности, к площади этой поверхности:
P = F / A
где P - давление, F - сила, A - площадь поверхности.
Давление измеряется в Паскалях (Па) или в единицах, пропорциональных Паскалям.
В уравнении состояния идеального газа давление выступает как одна из переменных величин, которая описывает состояние газа. Оно зависит от количества молекул газа, их средней энергии и объема, занимаемого газом.
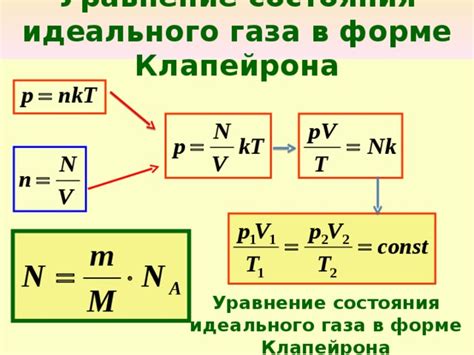
Уравнение состояния идеального газа выражает зависимость между давлением, объемом и температурой газа:
PV = nRT
где P - давление, V - объем газа, n - количество вещества, R - универсальная газовая постоянная, T - температура в абсолютных единицах.
Давление играет важную роль во многих физических процессах, таких как сжатие газа, движение жидкостей и твердых тел, а также является основным параметром для измерения атмосферного давления.
Температура и ее роль в уравнении состояния идеального газа
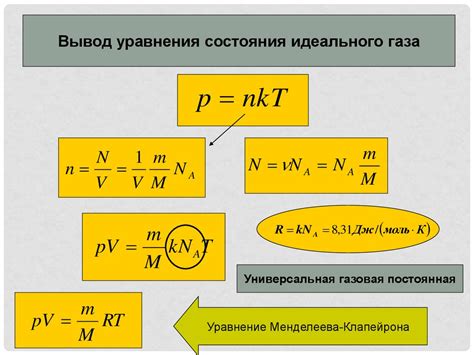
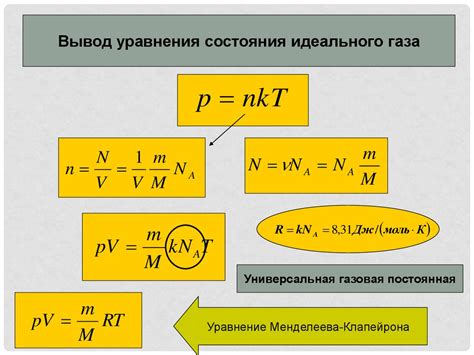
Уравнение состояния идеального газа выражается следующим образом:
PV = nRT
Где:
- P - давление газа в паскалях (Па)
- V - объем газа в кубических метрах (м³)
- n - количество вещества газа в молях (моль)
- R - универсальная газовая постоянная, примерное значение которой равно 8,314 Дж/(моль·К)
- T - абсолютная температура газа в кельвинах (К)
Таким образом, температура играет важную роль в уравнении состояния идеального газа, потому что изменение ее значения может привести к изменению давления и объема газа в соответствии с законами идеального газа.
Объем газа и способы его измерения

Существует несколько способов измерения объема газа. Один из самых распространенных методов - использование стеклянных сосудов, таких как колбы или баллоны. Для измерения объема в таких сосудах обычно используется шкала или маркировка на их поверхности. Метод основывается на том, что объем газа можно измерить по его размещению в контейнере.
Другой способ измерения объема газа - использование газовых счетчиков. Газовые счетчики обычно устанавливаются на трубопроводах, через которые проходит газ, и автоматически измеряют объем прошедшего газа. Этот метод позволяет получить точные и надежные данные о объеме газа, который используется или передается.
Более точные и сложные методы измерения объема газа включают использование устройств, таких как испарители, хроматографы или пирометры. Эти приборы позволяют измерить объем газа с высокой точностью и провести дополнительные анализы и исследования свойств газовой смеси.
Измерение объема газа играет важную роль в науке и промышленности. Оно позволяет ученым и инженерам понять и предсказать поведение газовых смесей, а также определять физические и химические свойства газа. Без точного измерения объема газа невозможно достичь точности и надежности в исследованиях и технических процессах, связанных с газовыми смесями.
Молярная масса и ее связь с уравнением состояния идеального газа

Уравнение состояния идеального газа связывает давление, объем и температуру газа и позволяет предсказывать его поведение при изменении условий. Уравнение состояния идеального газа можно записать в форме:
PV = nRT
где P - давление газа, V - его объем, n - количество вещества в молях, R - универсальная газовая постоянная, T - абсолютная температура газа.
Молярная масса может быть использована для выражения количества вещества в молях. Для этого необходимо знать массу вещества и его молярную массу. Количество вещества (n) выражается формулой:
n = масса / молярная масса
Таким образом, для использования уравнения состояния идеального газа и прогнозирования поведения газа, необходимо знать молярную массу вещества. Важно отметить, что уравнение состояния идеального газа применимо только для идеальных газов, а значения давления, объема и температуры должны быть выражены в соответствующих единицах измерения.
Использование молярной массы в связи с уравнением состояния идеального газа позволяет ученым и химикам предсказывать и анализировать поведение газового состояния материи при различных изменениях условий, что имеет большое значение в различных областях науки и промышленности.
Константы в уравнении состояния идеального газа и их значения

Уравнение состояния идеального газа связывает давление, объем, температуру и количество вещества газа. В этом уравнении присутствуют некоторые константы, которые играют важную роль в его формулировке.
Одна из таких констант - универсальная газовая постоянная, обозначаемая символом R. Значение этой константы зависит от выбранной системы единиц и часто представлено в следующих видах:
Значение в СИ: R = 8.31446261815324 Дж/(моль·К)
Значение в СГС: R = 8.31446261815324 × 10^7 эрг/(г·К)
Константа Больцмана, обозначаемая символом k, также является важной составляющей уравнения состояния идеального газа. Значение этой константы связывает энергию частиц с их температурой:
Значение в СИ: k = 1.380649 × 10^-23 Дж/К
Значение в СГС: k = 1.380649 × 10^-16 эрг/К
Помимо этих констант, уравнение состояния идеального газа может также включать значения атомных и молекулярных масс, а также константу Авогадро, которая определяет количество частиц в одном моле газа.
Знание значений этих констант позволяет более точно и удобно использовать уравнение состояния идеального газа при решении задач физики и химии.
Использование уравнения состояния идеального газа в практике
Одним из самых распространенных применений уравнения состояния идеального газа является его использование в химических реакциях. Зная параметры газа (давление, объем, температура) до и после реакции, можно использовать уравнение Клапейрона, чтобы определить изменения объема, давления или температуры в процессе химической реакции.
Уравнение состояния идеального газа также применяется в инженерии и физике. Оно используется при проектировании и расчете работы газовых силовых установок, таких как двигатели внутреннего сгорания. Зная параметры газа внутри двигателя и физические свойства рабочих газов, можно использовать уравнение состояния для определения эффективности работы двигателя и расчета его характеристик.
Уравнение состояния идеального газа необходимо также при проведении экспериментов и измерениях. Оно позволяет учитывать изменения давления и объема газа при изменении температуры, что существенно влияет на точность измерений.
Кроме того, уравнение состояния идеального газа применяется в термодинамике и газовой динамике для решения различных задач, связанных с поведением газов. Использование уравнения позволяет проводить расчеты и прогнозировать изменения параметров газа в различных условиях.
Таким образом, уравнение состояния идеального газа является важным инструментом в практических приложениях, позволяя проводить расчеты, прогнозировать изменения параметров газа и учитывать их в различных областях науки и техники.
Сравнение уравнения состояния идеального газа с реальными газами
В отличие от идеального газа, реальные газы обладают некоторыми особенностями. Они могут образовывать силы межмолекулярного взаимодействия, которые недопустимы в модели идеального газа. Такие силы, как ван-дер-Ваальсовы силы или силы диполь-дипольного взаимодействия, могут приводить к изменению объема и давления газа.
Кроме того, реальные газы не всегда могут быть сжаты до бесконечно малого объема или нагреты до бесконечно высокой температуры, что предполагается в идеальном газовом законе. Такие явления, как конденсация или ионизация газов, которые изменяют их свойства, следует учитывать в расчетах.
Для описания поведения реальных газов разработаны более сложные уравнения состояния, в которых учитываются различные параметры и условия. Некоторые из таких уравнений состояния включают учет молекулярных связей, инерцию молекул, наличие ионов или положительного и отрицательного зарядов, а также поправки на высокое давление и низкую температуру.
Использование уравнений состояния реальных газов является важным для получения более точных результатов в научных и технических расчетах. Они позволяют учесть реальные условия и свойства газов и обеспечить более точные прогнозы и моделирование их поведения в различных условиях.