Гибридизация – это процесс в химии, при котором атомы объединяются для образования новых молекул и соединений. Определение типа гибридизации является важным шагом в понимании свойств молекул и их поведения.
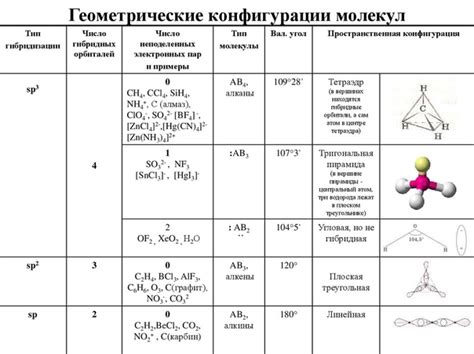
Определить тип гибридизации можно с помощью нескольких ключевых признаков. Один из них – это геометрическая форма молекулы. Если молекула имеет линейную форму, то атомы гибридизируются типом sp, при котором один s-орбитальный и один p-орбитальный электрон объединяются. Если молекула имеет плоскую треугольную форму, то атомы гибридизируются типом sp2, при котором одна s-орбитальная и две p-орбитальные электроны объединяются.
И наконец, если молекула имеет плоскую четырехугольную форму или форму пирамиды, то атомы гибридизируются типом sp3, при котором одна s-орбитальная и три p-орбитальные электроны объединяются. Зная геометрию молекулы, можно легко определить тип гибридизации и далее исследовать ее свойства и реактивность.
Что такое гибридизация?

Гибридизация используется для объяснения формы молекул и связей между атомами в них. Важными типами гибридизации являются гибридизация s, p и d орбиталей. Гибридизация помогает предсказать углы связей, геометрию молекул и их химические свойства.
Гибридизация s происходит, когда одна s-орбиталь и одна или несколько p-орбиталей смешиваются в новый набор орбиталей. При гибридизации s образуется две новые sp-орбитали. Гибридизация sp характерна для молекул с линейной геометрией, таких как CO2.
Гибридизация sp2 возникает при смешивании одной s-орбитали и двух p-орбиталей, образуя три новые sp2-орбитали. Такая гибридизация типична для молекул с плоской треугольной геометрией, например, этилен (C2H4).
Гибридизация sp3 происходит, когда одна s-орбиталь и три p-орбитали смешиваются, образуя четыре новые sp3-орбитали. Гибридизация sp3 обычно связана с ковалентной связью углеродных атомов в молекулах, таких как метан (CH4).
Используя знания о гибридизации, можно дать более точные описания структур и свойств химических соединений. Гибридизация важна для понимания химических реакций и функционирования органических и неорганических соединений.
Значение гибридизации в химии
Гибридизация важна, потому что она позволяет определить тип связей и геометрию молекулы. В химии существуют различные типы гибридизации, такие как sp, sp2 и sp3, которые обуславливают форму и характер связей в молекуле.
Гибридизация также играет важную роль в определении химической активности молекулы. Специфическая гибридизация может влиять на возможность молекулы участвовать в различных реакциях и взаимодействиях с другими веществами.
Изучение гибридизации позволяет химикам лучше понять связи и структуру молекул, что имеет важное значение для разработки новых лекарственных препаратов, материалов и катализаторов.
- Гибридизация помогает определить тип связей и геометрию молекулы
- Гибридизация влияет на химическую активность молекулы
- Гибридизация является важным инструментом в разработке новых материалов и препаратов
Способы определения типа гибридизации

Определение типа гибридизации атома в молекуле можно осуществить с помощью следующих методов и признаков:
| Способ | Описание |
|---|---|
| 1. Определение геометрической формы молекулы | Молекула с определенной геометрической формой чаще всего имеет определенный тип гибридизации. Например, линейная форма молекулы может указывать на гибридизацию sp, а треугольная форма - на гибридизацию sp2. |
| 2. Информация об атоме, связанном с гибридизированным атомом | Информация о типе спаивания атомов, связанных с гибридизированным атомом, может намекать на тип гибридизации. Например, если атом спаивается с тремя другими атомами, то это может указывать на гибридизацию sp2. |
| 3. Сравнение химической связи | Химическая связь, образованная гибридизированным атомом, имеет свои характеристики, которые могут указывать на тип гибридизации. Например, химическая связь, образованная гибридизированным атомом sp3, обычно имеет тетраэдрическую структуру. |
| 4. Расчет гибридизационного индекса | Гибридизационный индекс - это числовое значение, которое показывает, какие типы орбиталей участвуют в гибридизации. Расчет гибридизационного индекса может быть полезным способом определения типа гибридизации. |
Используя указанные способы определения типа гибридизации, можно более точно определить структуру и свойства молекулы, что важно для понимания химических процессов и реакций.
Теория Вальзера-Казахина

Согласно этой теории, гибридизация атомов происходит путем смешивания s- и p-орбиталей. Гибридизация может быть сп-гибридизацией, sp2-гибридизацией или sp3-гибридизацией, в зависимости от количества гибридных орбиталей, образованных изначальными s- и p-орбиталями.
Сп-гибридизация происходит, когда атом гибридизирует только одну s-орбиталь и одну p-орбиталь, образуя две гибридные sp-орбитали. Такая гибридизация встречается, например, в алкенах, где две группы заместителей находятся в одной плоскости.
Sp2-гибридизация происходит, когда атом гибридизирует одну s-орбиталь и две p-орбитали, образуя три гибридные sp2-орбитали. Такая гибридизация встречается, например, в алкенах и алкинах, где три группы заместителей находятся в одной плоскости.
Sp3-гибридизация происходит, когда атом гибридизирует одну s-орбиталь и три p-орбитали, образуя четыре гибридные sp3-орбитали. Такая гибридизация встречается, например, в насыщенных углеводородах, где четыре группы заместителей расположены в трехмерном пространстве.
Таким образом, теория Вальзера-Казахина является важным инструментом для определения типа гибридизации атомов в органических молекулах и позволяет предсказывать и объяснять их химические свойства.
Метод определения гибридизации через связи

Один из методов определения типа гибридизации атома основывается на анализе связей, образованных этим атомом. По типу связей можно сделать предположение о гибридизации атома.
Если атом образует одинарную связь, то это указывает на гибридизацию sp3. В этом случае, четыре гибридизованных орбиталя представляют собой четыре одинарные связи, соединяющие данный атом с другими атомами.
Если атом образует двойную связь, то это может указывать на гибридизацию sp2 или sp. Если атом образует только одну двойную связь, то это указывает на гибридизацию sp2. В этом случае, три гибридизованные орбиталя представляют собой три связи: две одинарные и одну двойную.
Если атом образует тройную связь, то это указывает на гибридизацию sp. В этом случае, две гибридизованные орбиталя представляют собой две связи: одну одинарную и одну тройную.
Этот метод определения гибридизации через связи является одним из основных и широко используется в химии.
Применение гибридизации в органической химии
1. Гибридизация сп3. Гибридизация сп3 происходит в углеродных атомах, которые образуют одиночные связи. Примером является метан (CH4), где четыре атома водорода соединяются с углеродом через одиночные связи. Гибридизация сп3 позволяет образованию ковалентных связей с конкретной геометрией и углом.
2. Гибридизация сп2. Гибридизация сп2 встречается в углеродных атомах, которые образуют двойные связи. Например, этилен (С2H4) имеет два углеродных атома, каждый из которых образует одну двойную связь и две одиночные связи. Гибридизация сп2 позволяет образованию плоской геометрии и позволяет молекуле быть плоской и более реакционно-активной.
3. Гибридизация сп. Гибридизация сп встречается в углеродных атомах, которые образуют тройные связи. Например, ацетилен (С2H2) имеет два углеродных атома, каждый из которых образует одну тройную связь и одну одиночную связь. Гибридизация сп позволяет образованию линейной геометрии и, также как и гибридизация сп2, делает молекулы более реакционно-активными.
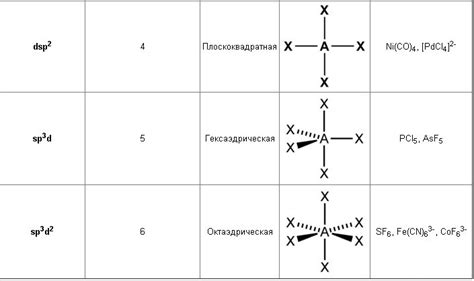
4. Гибридизация сп3d и сп3d2. В некоторых случаях углеродные атомы в органических молекулах могут образовывать положение гибридизации, отличное от сп, сп2 или сп3. Например, бор (B) может образовывать трехцентровые связи, где он гибридизуется в сп3d или сп3d2. Этот тип гибридизации позволяет образованию сложных мноскоступенчатых структур и реакционной активности.
Способы определения гибридизации при анализе молекул
Определение гибридизации может быть важным шагом в анализе молекул, так как это помогает понять структуру и свойства химических соединений. Существуют несколько способов определения гибридизации в молекулах, включая:
| Метод | Описание |
|---|---|
| Метод Вальда | Этот метод основан на подсчете общего числа замещенных и незамещенных электронных пар в центральном атоме. По результатам подсчета гибридизация определяется путем сопоставления общего числа электронных пар с определенным типом гибридизации. |
| Метод Вина–Контура | В этом методе сравниваются геометрические параметры молекулы с параметрами, характерными для различных типов гибридизации. Например, углы между связями и длины связей могут указывать на определенный тип гибридизации. |
| Спектроскопические методы | Спектроскопические методы, такие как ядерное магнитное резонанс (ЯМР) и инфракрасная спектроскопия, могут также помочь определить гибридизацию молекул. Эти методы основаны на изучении изменений в спектрах при изменении типа гибридизации. |
Использование этих методов в сочетании позволяет более точно определить гибридизацию в молекулах и получить более полное представление о их структуре и свойствах.
Практическое применение гибридизации
Гибридизация имеет широкие практические применения в химии и биологии. Ниже приведены некоторые примеры использования гибридизации в научных исследованиях и промышленности:
- Гибридизация в химическом анализе: гибридизированные состояния атомов могут быть использованы для определения структуры и состава химических соединений. Например, гибридизация может быть использована для определения геометрии молекулы, а также для выявления наличия двойных или тройных связей.
- Гибридизация в органической химии: гибридизация является важным инструментом в органической химии. Она позволяет предсказывать и объяснять структуру и поведение органических соединений. Гибридизированные состояния атомов определяют характер связи, а также окружение и распределение зарядов в молекуле.
- Гибридизация в биологии: гибридизация играет важную роль в молекулярной биологии. Она может быть использована для изучения генетической информации, анализа последовательностей ДНК и РНК, а также для создания гибридных молекул ДНК.
- Гибридизация в материаловедении: гибридизированные материалы могут иметь уникальные физические свойства и широкий спектр применений. Например, гибридизация может быть использована для создания материалов с повышенной прочностью, термической стабильностью, электропроводностью и другими свойствами.
Это лишь некоторые примеры использования гибридизации, которые демонстрируют её значимость и широкий спектр применений. Гибридизация является важным понятием в химии и биологии и играет ключевую роль в понимании и исследовании природы химических соединений и биологических молекул.
Гибридизация в качестве объяснения строения соединений
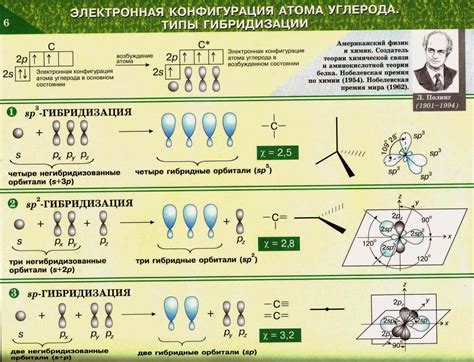
В химии существуют три основных типа гибридизации: $sp$, $sp^2$ и $sp^3$. Углерод, например, может проявлять все три типа гибридизации и образовывать различные структуры в органических соединениях.
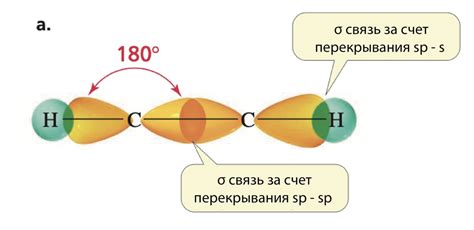
- Гибридизация $sp$ возникает, когда одна $s$-орбиталь и одна $p$-орбиталь атома гибридизуются, образуя две гибридные $sp$-орбитали с углом 180° между ними. Этот тип гибридизации наблюдается, например, в углекислом газе (CO2), где две $sp$-орбитали углерода связаны с кислородом.
- Гибридизация $sp^2$ возникает, когда одна $s$-орбиталь и две из трех $p$-орбиталей атома гибридизуются, образуя три гибридные $sp^2$-орбитали в одной плоскости. В молекуле эти орбитали заполнены электронами и образуют связи с другими атомами. Примером молекулы с гибридизацией $sp^2$ является этилен (C2H4).
- Гибридизация $sp^3$ возникает, когда одна $s$-орбиталь и все три $p$-орбитали атома гибридизуются, образуя четыре гибридные $sp^3$-орбитали в пространстве. Этот тип гибридизации встречается, например, в метане (CH4), где углерод образует четыре одинаковых связи с водородом.
Гибридизация является эффективным инструментом для объяснения строения соединений и предоставляет основу для понимания связей между атомами в молекулах. Понимание гибридизации позволяет установить геометрию молекулы, определить типы связей и предсказать химические свойства соединений.