Радиус атома – важная физическая характеристика атома, которая имеет существенное значение в химии и физике. Он указывает на расстояние от центра атома до его внешней электронной оболочки, определяя размер самого атома.
Ученики средней школы обычно изучают атомы и элементы в ходе курса химии в 9 классе. Однако, как определить радиус атома? Правильный ответ можно найти, обратившись к Таблице Менделеева.
Таблица Менделеева представляет собой организацию химических элементов по порядку возрастания их атомного номера, атомной массы и других химических свойств. Каждый элемент имеет свою ячейку, в которой указывается его символ, атомный номер и атомная масса.
С помощью Таблицы Менделеева можно найти радиус атома. Обратите внимание на то, что атомы находятся в пределах групп и периодов. Группы вертикальные, а периоды горизонтальные строки. Чтобы найти радиус атома, можно обратиться к номеру периода и группы элемента в Таблице Менделеева.
Зачем нужно определять радиус атома?

Определение радиуса атома позволяет:
- Предсказать и объяснить свойства вещества. Радиус атома влияет на многие химические и физические свойства вещества, включая реакционную способность, электронную структуру, теплоемкость и многое другое. Зная радиус атома, можно предсказать, как вещество будет взаимодействовать с другими веществами и какие свойства будет иметь.
- Исследовать и классифицировать элементы. Определение радиуса атома позволяет создать систематическую таблицу элементов, такую как таблица Менделеева, где элементы располагаются в порядке возрастания атомного номера и радиуса атома. Это помогает упорядочить элементы, предсказать их свойства и открывать новые закономерности.
В целом, определение радиуса атома является важным инструментом для изучения химической структуры и свойств вещества, а также для построения систематических классификаций элементов. Это помогает углубить наше понимание мира вокруг нас и применить полученные знания в различных областях науки и технологии.
Таблица Менделеева как основа для определения радиуса атома
Радиус атома - это расстояние от центра атома до его наружной оболочки, где находятся электроны. Химические свойства каждого элемента определяются размером и строением его атома. Радиус атомов может варьироваться в зависимости от различных факторов, включая атомные номера и электронную конфигурацию элементов.
В таблице Менделеева радиусы атомов указываются в пикометрах (пм). Для большинства элементов указываются значения радиусов по краю и по гало (оболочке) атома. Радиусы атомов увеличиваются по направлению вниз и вправо в таблице.
| Элемент | Радиус атома (по краю) (пм) | Радиус атома (по гало) (пм) |
|---|---|---|
| Литий (Li) | 152 | 182 |
| Натрий (Na) | 186 | 227 |
| Калий (K) | 220 | 275 |
| Рубидий (Rb) | 235 | 303 |
Из таблицы видно, что радиусы атомов увеличиваются при движении вниз по группам, из-за постепенного добавления новых энергетических оболочек электронов. Также, при движении вправо по периодам, радиусы атомов уменьшаются в связи с увеличением силы притяжения ядра и электронов.
Что такое радиус атома и как его измерить?

Измерить радиус атома можно различными методами. Один из самых распространенных методов - это определение радиуса атома по таблице Менделеева. В таблице Менделеева указано атомное число атомов каждого элемента, а также их атомные массы. Используя эти данные, можно вычислить радиус атома.
Для этого существуют различные формулы и эмпирические соотношения, которые позволяют оценить радиус атома. Например, для атомов, представленных в таблице Менделеева, можно использовать формулу, основанную на атомной массе и атомном числе:
радиус = (3/4πNρ)^1/3
где N - атомное число, ρ - плотность элемента.
Однако стоит отметить, что радиус атома - это среднее значение, которое может меняться в зависимости от окружения и условий. Поэтому методы измерения радиуса атома носят исключительно приближенный характер и могут быть субъективными.
Важно помнить, что радиус атома - это величина относительная, и необходимо сравнивать радиусы атомов разных элементов для получения полной картины. Таблица Менделеева является хорошим инструментом для этой задачи и помогает установить связь между радиусами атомов разных элементов.
Какие факторы влияют на размер атома?

Размер атома определяется несколькими факторами, включая:
| Фактор | Описание |
|---|---|
| Заряд ядра | Чем больше заряд ядра, тем сильнее притяжение электронов, и тем меньше размер атома. |
| Количество электронных оболочек | Чем больше электронных оболочек у атома, тем больше его размер, так как электроны занимают больше пространства. |
| Электронная конфигурация | Распределение электронов по энергетическим уровням оказывает влияние на размер атома. Например, атомы с полностью заполненными энергетическими уровнями могут иметь меньший размер. |
| Валентность атома | Число валентных электронов, доступных для образования химических связей, также может влиять на размер атома. Например, валентность может определять, сколько атомов атом может притянуть или оттолкнуть в процессе образования связей. |
| Валентные связи | Образование валентных связей между атомами может привести к изменениям в размере атомов. Например, атомы, образующие ковалентные связи, могут становиться меньше или больше в результате обмена электронами с другими атомами. |
| Внешние условия | Температура, давление и другие внешние условия могут влиять на размер атома. Например, при высоком давлении атомы могут сближаться и становиться меньше, а при низкой температуре атомы могут сжиматься. |
Эти факторы в совокупности определяют размер атома и его химические свойства.
Принципы определения радиуса атома по таблице Менделеева

Определение радиуса атома основано на следующих принципах:
1. Тренды в периоде: Радиус атома увеличивается по мере движения слева направо вдоль периода. Это происходит из-за увеличения числа электронов и притяжения ядерных зарядов, что расширяет электронные оболочки атома.
2. Тренды в группе: Радиус атома увеличивается снизу вверх вдоль группы. В этом случае, электроны находятся на более близком расстоянии от ядра, что ведет к сокращению электронных оболочек и уменьшению радиуса атома.
3. Разрешения для ионов: Радиус ионов также можно определить по таблице Менделеева. Положительные ионы обладают более маленьким радиусом, чем соответствующие нейтральные атомы, из-за потери одного или нескольких электронов. Отрицательные ионы имеют более большой радиус в сравнении с нейтральными атомами, так как приобретают дополнительные электроны.
Понимание принципов определения радиуса атома по таблице Менделеева является важным для изучения химических свойств элементов и их соединений. Эти принципы позволяют нам анализировать тренды и установить логическую связь между радиусом атома и его положением в таблице Менделеева.
Как определить радиус атома с помощью таблицы Менделеева
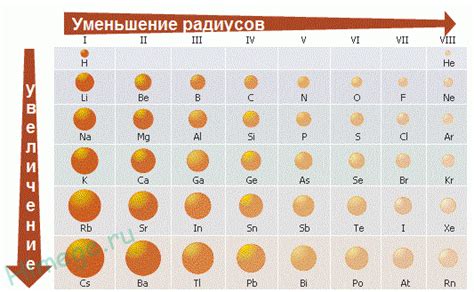
Для определения радиуса атома нужно проследить за изменениями его значений в таблице Менделеева от одного элемента к другому. Обратите внимание на экранирование изменениям размеров атомов в пределах одной группы и периода.
Если сравнивать атомный радиус элементов в одной группе, то снижение радиуса атома будет происходить с увеличением атомного номера, так как число энергетических уровней увеличивается. В том случае, когда атомные радиусы элементов в одной группе увеличиваются сверхмало или нет, это говорит о снижении эффективности этого главного квантового числа.
Определить радиус атома поможет также сравнение элементов в одном периоде таблицы Менделеева. В данном случае атомный радиус уменьшается с увеличением атомного номера из-за увеличения числа электронов в энергетических уровнях.
Примеры определения радиуса атома по таблице Менделеева.

Пример 1:
Рассмотрим химический элемент кальций (Ca) из таблицы Менделеева. Находим его порядковый номер - 20. Используя данное значение, находим информацию о радиусе атома в таблице Менделеева. У кальция указано значение радиуса атома равное 197 пикометров.
Пример 2:
Рассмотрим химический элемент кислород (O) из таблицы Менделеева. Находим его порядковый номер - 8. Используя данное значение, находим информацию о радиусе атома в таблице Менделеева. У кислорода указано значение радиуса атома равное 66 пикометрам.
Пример 3:
Рассмотрим химический элемент железо (Fe) из таблицы Менделеева. Находим его порядковый номер - 26. Используя данное значение, находим информацию о радиусе атома в таблице Менделеева. У железа указано значение радиуса атома равное 156 пикометров.
Таким образом, для определения радиуса атома по таблице Менделеева необходимо найти порядковый номер элемента и найти соответствующее значение радиуса атома в таблице.