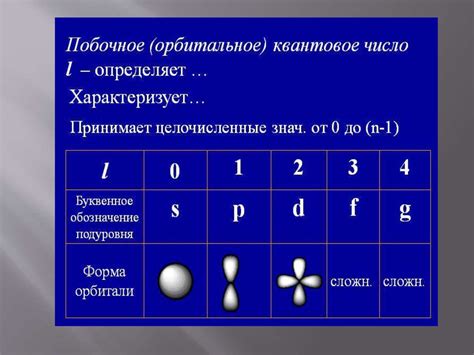
Орбитальное квантовое число – это одно из четырех основных квантовых чисел, которые определяют квантовое состояние электрона в атоме. Оно обозначается буквой l и может принимать значения от 0 до n-1, где n – главное квантовое число. Орбитальное квантовое число определяет форму орбитали – зоны в пространстве, где с наибольшей вероятностью можно найти электрон.
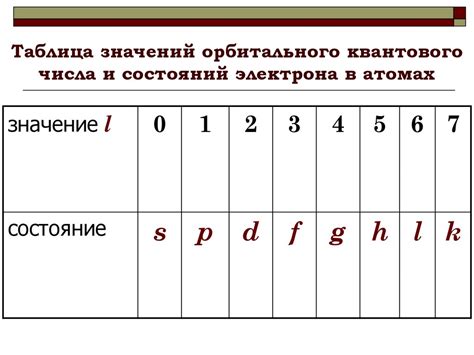
Орбитальное квантовое число l принимает значения:
- l = 0, обозначает s-орбиталь;
- l = 1, обозначает p-орбиталь;
- l = 2, обозначает d-орбиталь;
- l = 3, обозначает f-орбиталь.
Чем больше значение орбитального квантового числа, тем более сложную форму имеет орбиталь, в которой может находиться электрон. Так, s-орбиталь имеет форму сферы, p-орбиталь имеет форму фигуры, напоминающей двоякую шаровую каплю, а d-орбиталь уже более сложной формы.
Орбитальное квантовое число l является важным параметром при определении электронной конфигурации атома и позволяет установить количество электронных подуровней внутри каждого энергетического уровня. Оно также определяет значение орбитального момента, магнитный момент и спин электрона.
Понятие и назначение
Орбитальное квантовое число принимает целочисленные значения от 0 до n-1, где n - главное квантовое число, определяющее энергию и размер атомного орбиталя. Каждое значение l соответствует определенной форме орбитали: s, p, d, f и т.д. Например, при l=0 форма орбитали будет сферической (s-орбиталь), при l=1 - двухлопастной (p-орбиталь), при l=2 - щупальцевидной (d-орбиталь) и т.д.
Орбитальное квантовое число играет важную роль в предсказании и объяснении химических свойств элементов, так как оно определяет число подуровней энергии и общее число возможных электронов в атоме или молекуле.
Значение орбитального квантового числа
Орбитальное квантовое число, обозначаемое символом l, представляет собой одно из основных квантовых чисел в квантовой механике, описывающей электронную структуру атома. Оно определяет форму орбитали электрона и указывает на осевую симметрию этой орбитали относительно ядра.
Значение орбитального квантового числа l может быть любым целым числом в интервале от 0 до n-1, где n - главное квантовое число (принимает значения от 1 до бесконечности) и определяет главный энергетический уровень электрона.
Значение орбитального квантового числа l также связано с формой орбитали электрона. Например, для l = 0 орбитали имеют форму сферы (s-орбитали), для l = 1 - форму шарового кольца (p-орбитали), для l = 2 - форму двухшаровых колец взаимно перпендикулярных друг другу (d-орбитали) и т.д.
Максимальное значение орбитального квантового числа l на каждом энергетическом уровне определяет максимальное количество электронов, которые могут находиться на данной орбитали. Например, на s-орбитали может находиться до 2 электронов, на p-орбитали - до 6 электронов, на d-орбитали - до 10 электронов.
Орбитальное квантовое число имеет важное значение при понимании строения атома и химических связей между атомами, так как оно помогает определить положение и количество электронов в атоме и их вероятности обнаружения в конкретном объеме пространства.
Орбитальные квантовые числа в атомной физике
Орбитальные квантовые числа используются в атомной физике для описания электронных орбиталей атомов. Они помогают определить форму, размер и энергию электронной оболочки.
Первое орбитальное квантовое число, обозначаемое буквой n, определяет основной энергетический уровень электрона. Оно принимает значения от 1 до бесконечности, где n=1 соответствует самому ближайшему энергетическому уровню к ядру атома.
Второе орбитальное квантовое число, обозначаемое буквой l, определяет форму орбитали и момент импульса электрона. Значения l зависят от значения n и могут быть от 0 до (n-1). Например, для n=2 возможные значения l равны 0 и 1.
Третье орбитальное квантовое число, обозначаемое буквой m, связано с ориентацией орбитали в пространстве. Значения m зависят от значения l и могут принимать значения от -l до l включительно. Например, для l=1 возможные значения m равны -1, 0 и 1.
Четвертое орбитальное квантовое число, обозначаемое буквой s, описывает ориентацию спина электрона. Оно может иметь только два значения: +1/2 или -1/2.
Орбитальные квантовые числа позволяют систематически классифицировать электроны в атомах и объяснить их размещение на энергетических уровнях. Знание этих чисел позволяет более глубоко понять и предсказывать химические свойства элементов.
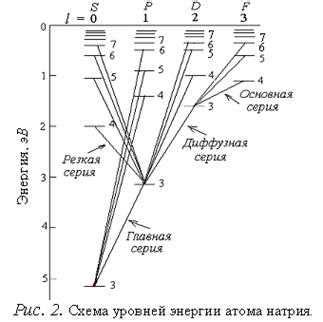
Орбитальное квантовое число и энергетические уровни

Каждое значение орбитального квантового числа l соответствует определенной форме орбитали. Например, для l=0 электрон находится в s-орбитали, которая имеет сферическую форму. При l=1 электрон находится в p-орбитали, которая имеет форму двухполюсника. Для l=2 электрон находится в d-орбитали, которая имеет форму четырехслоя с гнездами между ними.
Значение орбитального квантового числа l также определяет количество подуровней энергии, которые есть в соответствующем энергетическом уровне. Количество подуровней равно значению l. Например, при l=0 (s-орбиталь) есть 1 подуровень, при l=1 (p-орбиталь) есть 3 подуровня, при l=2 (d-орбиталь) есть 5 подуровней.
Каждый подуровень, соответствующий значению орбитального квантового числа l, характеризуется вторым квантовым числом, магнитным квантовым числом (ml). Оно принимает значения от -l до +l и определяет ориентацию орбитали в пространстве вокруг ядра атома.
Орбитальное квантовое число и энергетические уровни существенно влияют на химические свойства атомов, так как определяют расположение электронов и их энергетические состояния. Знание этих характеристик позволяет понять, почему некоторые атомы имеют определенные электронные конфигурации и как они взаимодействуют с другими атомами в химических реакциях.
Связь орбитального квантового числа с формой орбитали

Орбитальное квантовое число, обозначаемое буквой l, определяет форму орбитали атома. Оно можно рассматривать как меру орбитального момента импульса электрона.
Значение орбитального квантового числа определяет тип орбитали и форму ее поверхности. Оно может принимать целые значения от 0 до n - 1, где n - главное квантовое число. Каждое значение l соответствует определенному типу орбитали:
- l = 0 соответствует орбитали s и имеет форму сферы;
- l = 1 соответствует орбитали p и имеет форму шестилистника;
- l = 2 соответствует орбитали d и имеет форму двухволностей;
- l = 3 соответствует орбитали f и имеет форму сложных волностей.
Это лишь некоторые примеры, но форма орбитали соответствует определенному значению орбитального квантового числа. Чем выше значение числа l, тем сложнее форма орбитали. Кроме того, форма орбитали также зависит от значения главного квантового числа n.
Знание о связи орбитального квантового числа с формой орбитали позволяет понять, как электроны располагаются вокруг атомов и как взаимодействуют. Это является важным аспектом в понимании поведения химических элементов и их реакций.
Значение орбитального квантового числа для химических элементов
Орбитали с l=0 называются s-орбиталями и представляют собой сферические орбитали. Они могут быть заполнены максимум двумя электронами, обладающими разнополыми спинами.
Орбитали с l=1 называются p-орбиталями и имеют форму шестилистника. Каждая p-орбиталь может содержать максимум шесть электронов.
Орбитали с l=2 называются d-орбиталями и имеют форму четырехлистника. Каждая d-орбиталь может содержать максимум десять электронов.
Орбитали с l=3 называются f-орбиталями и имеют особую сложную форму. Каждая f-орбиталь может содержать максимум четырнадцать электронов.
Значение орбитального квантового числа для химических элементов позволяет определить, в какой орбитали находятся электроны в атоме. Это важно для понимания электронной структуры и свойств химических элементов.
Орбитальные квантовые числа и спин
Для полного определения состояния электрона в атоме необходимо знать его орбитальные квантовые числа, а также его спин. Орбитальные квантовые числа описывают форму орбитали, на которой находится электрон, а спин определяет его вращение вокруг своей оси.
Орбитальные квантовые числа обозначаются буквами s, p, d, f и указывают на форму орбитали. Квантовое число s соответствует шаровидной орбитали, p - двухлопастной орбитали, d - четырехлопастной орбитали, а f - пятилопастной орбитали.
Спин электрона может иметь два возможных значения: вверх или вниз, обозначаемые стрелками вверх и вниз соответственно. Спин электрона имеет значение для его магнитного момента и его взаимодействия с магнитными полями.
Таким образом, каждый электрон в атоме характеризуется четырьмя квантовыми числами: главным квантовым числом n, описывающим энергию электрона, орбитальным квантовым числом l, определяющим форму орбитали, магнитным квантовым числом m, определяющим пространственное распределение орбитали, и спиновым квантовым числом s, описывающим спин электрона.
Зная значения орбитальных квантовых чисел и спина электрона, можно полностью определить его состояние и свойства в атоме. Эти характеристики имеют особое значение при описании электронных конфигураций и химических связей в молекулах.
| Орбиталь | Орбитальное квантовое число (l) | Магнитное квантовое число (m) |
|---|---|---|
| сферическая (s) | 0 | 0 |
| два поперечных пучка (p) | 1 | -1, 0, 1 |
| четыре поперечных пучка (d) | 2 | -2, -1, 0, 1, 2 |
| пять поперечных пучков (f) | 3 | -3, -2, -1, 0, 1, 2, 3 |
Примеры использования орбитального квантового числа
Вот несколько примеров использования орбитального квантового числа:
1. Для атомов водорода орбитальное квантовое число l может принимать только одно значение: 0. Это означает, что орбитали водородного атома имеют форму сферы.
2. Для атомов с многоэлектронной оболочкой орбитальное квантовое число l может принимать несколько значений. Например, для оболочки n=2 орбитальное квантовое число l может быть равно 0 или 1. При l=0 форма орбитали будет сферической, а при l=1 - форма будет показывать два узла и будет ближе к форме поблочных орбиталей.
3. Орбитальное квантовое число также влияет на энергию орбиталей. Например, внутренние орбитали (с меньшим l) имеют меньшую энергию, чем внешние орбитали (с большим l). Это связано с формой орбиталей и их электронным распределением.
4. В комбинаторике орбитальное квантовое число l также играет роль в определении числа орбиталей данного типа в каждом электронном подуровне. Например, для s-подуровней l равно 0, поэтому в субуровне может быть только одна s-орбиталь. Для p-подуровней l равно 1, поэтому в субуровне может быть три p-орбитали (px, py, pz).