Определение массы кислоты в растворе является важной задачей в химии. Кислоты играют важную роль во многих процессах, и знание их концентрации в растворе позволяет управлять химическими реакциями. Существует несколько методов и расчетов, которые могут быть использованы для определения массы кислоты в растворе.
Один из наиболее распространенных методов - титрование. Этот метод основан на реакции между кислотой и щелочью, где известна концентрация щелочи и его расход. Определение массы кислоты происходит путем определения точки эквивалентности, когда количество добавленной щелочи эквивалентно количеству кислоты в растворе.
Для определения массы кислоты можно также использовать метод анализа по удалению воды. Этот метод основан на том, что при нагревании раствора кислоты оставшейся в результате испарения будет составлять разность массы до нагревания и после нагревания. Разность этих масс и будет массой кислоты в растворе.
Что такое масса кислоты?

Определить массу кислоты в растворе можно с помощью различных методов и расчетов. Один из наиболее распространенных способов – титрование. При этом методе масса кислоты определяется путем измерения объема стандартного раствора, требующегося для полного нейтрализации данной кислоты.
Также для расчета массы кислоты можно использовать формулу, основанную на знании концентрации раствора и его объеме. При известной концентрации и объеме раствора, можно рассчитать массу кислоты с помощью формулы:
Масса кислоты = объем раствора × концентрация кислоты
Точное определение массы кислоты в растворе играет важную роль в различных областях науки и промышленности, таких как химия, аналитика, фармацевтика и другие.
Методы определения массы кислоты

- Титрование: Этот метод основан на реакции между кислотой и щелочью. Раствор кислоты добавляется к щелочному раствору с известной концентрацией. Затем выполняется титрование, при котором кислота ищет точку эквивалентности, когда всех ионов кислоты не остается. Масса кислоты может быть определена на основе объема добавленной щелочи и ее концентрации.
- Гравиметрический метод: В этом методе масса кислоты определяется путем нагревания раствора и высушивания дестилированной воды. После этого процесса остается только чистая кислота, и можно определить ее массу путем взвешивания.
- Газовая вольтамперометрия: Этот метод основан на измерении объема выделившегося газа при химической реакции кислоты с металлом. С помощью этой информации можно рассчитать массу кислоты в растворе.
- Колориметрия: Этот метод основан на использовании цветовых показателей для определения концентрации кислоты в растворе. Концентрация кислоты может быть рассчитана путем сравнения цветового показателя раствора с известными стандартами.
Каждый из этих методов имеет свои преимущества и ограничения, и выбор метода зависит от конкретной задачи и доступных ресурсов.
Титриметрический метод
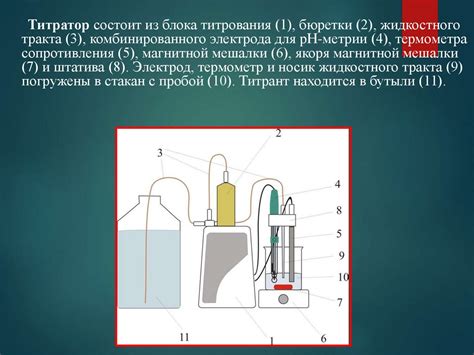
Для проведения титриметрического метода необходимо:
- Подготовить стандартный раствор щелочи или металла, чья концентрация известна. Раствор при этом должен быть точно отмеренного объема.
- Провести титрование, добавляя стандартный раствор кислоты медленными порциями к раствору щелочи или металла с использованием индикатора. Индикатор меняет свой цвет в зависимости от окончания реакции.
- Зафиксировать показания бюретки в момент окончания реакции, когда исчезает окрашивание индикатора. Рассчитать количество добавленного стандартного раствора кислоты.
- На основе данных титрования и объема стандартного раствора кислоты можно определить массу кислоты в растворе по формуле.
Титриметрический метод позволяет получить точные результаты определения концентрации кислоты в растворе, однако требует точного отмеривания объемов и аккуратности в проведении титрования. Значительное преимущество этого метода заключается в возможности применения к различным типам кислот и щелочей, а также в его относительной простоте.
Гравиметрический метод

Для проведения гравиметрического анализа раствора с содержанием кислоты, необходимо добавить кислоту в избытке указанного реагента. Затем полученный осадок нужно отфильтровать, осушить и взвесить. Масса осадка будет пропорциональна массе кислоты в исходном растворе.
Гравиметрический метод имеет ряд преимуществ, включая высокую точность и надежность результатов. Однако он требует тщательной подготовки образцов, а также длительных и трудоемких процедур обработки и анализа.
Для рассчета массы кислоты по гравиметрическому методу необходимо знать массу образовавшегося осадка и уравнение реакции между кислотой и реагентом. С помощью стехиометрических расчетов можно определить массу кислоты, исходя из известной массы осадка.
Гравиметрический метод является одним из наиболее точных и надежных методов определения массы кислоты в растворе. Он широко используется в химической аналитике и научных исследованиях.
Фотометрический метод
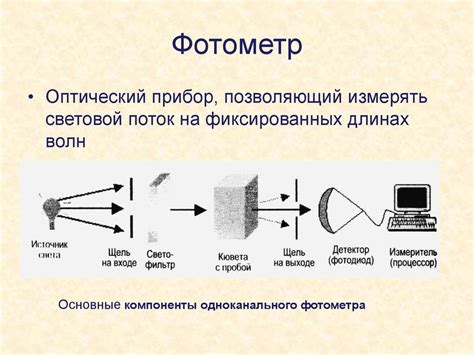
Принцип фотометрического метода заключается в следующем: кислотный раствор освещается определенной длиной волны, которая поглощается веществом кислоты. Плавность, а именно степень поглощения света определяет концентрацию кислоты в растворе. Для измерения оптической плотности используется фотометр, который позволяет точно определить показатель поглощения света.
Одним из существенных преимуществ фотометрического метода является его высокая точность и чувствительность. Также, необходимо отметить, что при использовании данного метода можно принять только концентрацию кислоты в растворе, однако массу кислоты можно вычислить, зная объем раствора и его концентрацию.
Для определения массы кислоты в растворе по фотометрическому методу, необходимо знать коэффициент поглощения кислоты при определенной длине волны и пути поглощения света в растворе. На основе этих данных можно провести расчет и получить нужную информацию.
Таким образом, фотометрический метод является эффективным и надежным способом определения массы кислоты в растворе. Он позволяет получить качественные и количественные данные, необходимые для выполнения анализа и проведения экспериментов.
Расчеты массы кислоты

Для расчета массы кислоты необходимо знать молярную массу кислоты и концентрацию раствора. Молярная масса указывает на массу одного моля кислоты. Концентрация раствора выражается в молях кислоты на литр раствора.
Формула для расчета массы кислоты: масса = молярная масса × концентрация × объем раствора. Например, если молярная масса кислоты равна 36 г/моль, концентрация раствора составляет 0,1 моль/л, а объем раствора равен 100 мл, то масса кислоты будет равна:
| Молярная масса (г/моль) | Концентрация (моль/л) | Объем раствора (мл) | Масса кислоты (г) |
|---|---|---|---|
| 36 | 0,1 | 100 | 3,6 |
Таким образом, в данном примере масса кислоты в растворе составляет 3,6 г.
Важно учитывать, что точное определение массы кислоты в растворе требует также учета дополнительных факторов, например, ионизации кислоты, температуры, pH и т.д. Для точных расчетов рекомендуется обратиться к специальной литературе или провести конкретные эксперименты с использованием соответствующих методик и оборудования.
Расчет массы на основе экспериментальных данных

Для определения массы кислоты в растворе на основе экспериментальных данных необходимо провести ряд измерений и использовать соответствующие формулы. Важно иметь точные значения концентрации раствора, его объема и молярной массы кислоты.
1. Сначала измерьте объем раствора кислоты, используя мерную колбу или цилиндр. Запишите полученное значение в миллилитрах (мл) или литрах (л).
2. Далее, определите концентрацию раствора кислоты, проведя титрование или используя спектрофотометрию. Концентрация обычно выражается в молях на литр (М или Моль/л).
3. После этого, найдите молярную массу кислоты, которую вы используете. Для этого можно использовать таблицу химических элементов или справочные материалы.
4. Теперь, используя полученные значения, приступите к расчету массы кислоты. Для этого умножьте концентрацию раствора на его объем, чтобы получить количество молей кислоты. Затем умножьте количество молей на молярную массу кислоты, чтобы получить искомую массу.
Пример расчета массы на основе экспериментальных данных:
| Объем раствора кислоты (л) | Концентрация раствора (М) | Молярная масса кислоты (г/моль) | Рассчитанная масса кислоты (г) |
|---|---|---|---|
| 0.05 | 0.1 | 36.46 | 0.1823 |
Таким образом, масса кислоты в данном растворе составляет 0.1823 г.
Используя данные эксперимента и проведя необходимые расчеты, можно с уверенностью определить массу кислоты в растворе.
Расчет массы на основе химических формул
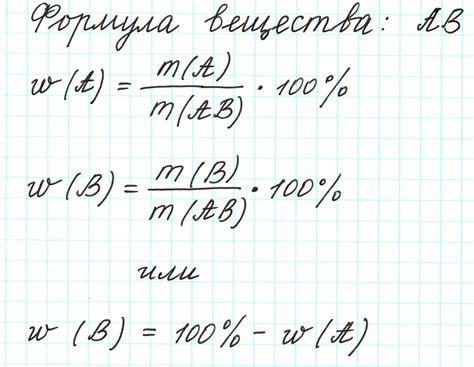
Для определения массы кислоты в растворе можно использовать химические формулы и рассчитывать массу с помощью атомных масс элементов. Для этого необходимо знать формулу кислоты и концентрацию раствора.
Шаги расчета массы кислоты в растворе на основе химической формулы:
- Определите химическую формулу кислоты. Например, HCl (соляная кислота).
- Из формулы определите количество атомов каждого элемента. Например, в случае HCl - 1 атом водорода и 1 атом хлора.
- Определите атомные массы элементов. Для этого можно воспользоваться периодической системой элементов.
- Умножьте количество атомов каждого элемента на его атомную массу и сложите полученные значения.
- Рассчитайте массу кислоты в растворе, умножив полученную сумму на концентрацию раствора.
Пример расчета массы кислоты в растворе на основе химической формулы:
| Исходные данные: | |
|---|---|
| Формула кислоты: | HCl |
| Атомная масса водорода (H): | 1.01 г/моль |
| Атомная масса хлора (Cl): | 35.45 г/моль |
| Концентрация раствора: | 1.0 М |
Расчет:
Количество атомов водорода (H) = 1
Количество атомов хлора (Cl) = 1
Сумма (количество атомов * атомная масса) = (1 * 1.01 г/моль) + (1 * 35.45 г/моль) = 36.46 г/моль
Масса кислоты в растворе = (36.46 г/моль) * (1.0 М) = 36.46 г
Таким образом, масса соляной кислоты в растворе составляет 36.46 г.
Расчет массы на основе объема и концентрации

Для определения массы кислоты в растворе по объему и концентрации необходимо учесть формулу для расчета концентрации и мольную массу соответствующей кислоты.
Первым шагом является определение объема раствора кислоты, который измеряется в лабораторных условиях при помощи верного инструмента, такого как мерная колба или пипетка.
Далее следует узнать концентрацию кислоты в растворе, которая обозначается в процентах или молях на литр (M). Концентрация может быть указана на этикетке флакона или должна быть известна из других источников.
После получения объема и концентрации кислоты применяется следующая формула для расчета массы:
Масса (г) = объем (л) * концентрация (M) * мольная масса (г/моль)
Мольную массу можно найти в справочных источниках, таких как таблицы химических элементов.
Итак, зная объем раствора кислоты и ее концентрацию, можно легко расчитать массу, используя приведенную формулу, что поможет в дальнейших экспериментах и научных исследованиях.