История изотопов началась в начале XX века, когда физики Лоренц и Физгауэр обнаружили некоторые странности в поведении радиоактивных элементов. Оказалось, что некоторые элементы имеют одинаковое атомное число, но различную массу. Это противоречило тогдашним представлениям о строении атомов, но впоследствии привело к открытию нового физического явления – изотопии.
Принцип изотопии объясняется законом сохранения массового числа, согласно которому сумма количества протонов и нейтронов в атомном ядре равна атомному числу элемента. Именно благодаря этому закону мы можем определить массу изотопа.
Определение массы изотопа является важным шагом в изучении атомной физики и имеет множество практических применений, например, в медицине, археологии и радиоэкологии. Существуют различные методы определения массы изотопов, включая масс-спектрометрию, альфа-спектрометрию и бета-спектрометрию.
Закон сохранения массового числа
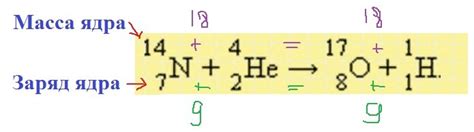
Массовое число - это сумма протонов и нейтронов в ядре атома. Оно обозначается символом A. В ядерной реакции взаимодействуют атомные ядра, находящиеся в начальном и конечном состояниях. Согласно закону сохранения массового числа, сумма массовых чисел в реагирующих ядрах должна быть равна сумме массовых чисел в конечных ядрах.
Этот закон позволяет определить массу изотопа на основе данных о ядерных реакциях и массовых числах ядер. Например, если известно массовое число исходного ядра, массовое число конечного ядра и число выпущенных или поглощенных частиц, можно рассчитать массу изотопа.
Пример:
Предположим, что произошла ядерная реакция, при которой поглощены два нейтрона. Массовое число исходного ядра составляет 10. Если массовое число конечного ядра равно 12, то масса изотопа будет равна 2 (12 - 10).
Таким образом, закон сохранения массового числа является важным инструментом для определения массы изотопа на основе данных о ядерных реакциях и массовых числах ядер.
Определение массы изотопа
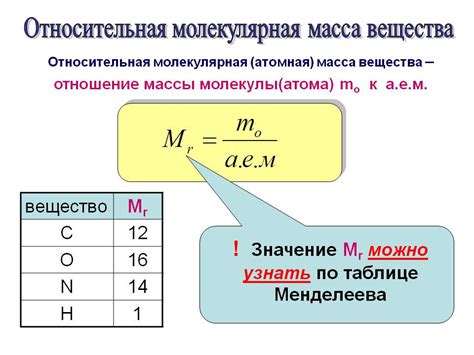
Масса изотопа определяется с использованием закона сохранения массового числа. Этот закон гласит, что сумма числа протонов и нейтронов в атомном ядре изотопа остается неизменной.
Для определения массы изотопа необходимо знать число протонов (атомного номера) и число нейтронов в ядре. Атомный номер можно найти в периодической системе химических элементов. Нейтронное число можно определить путем вычитания атомного номера из общего числа нуклонов в ядре.
Например, для определения массы изотопа углерода-12 необходимо найти число протонов и нейтронов в ядре: атомный номер углерода равен 6, а общее количество нуклонов в ядре равно 12. Таким образом, число нейтронов равно 12 минус 6, то есть 6. Следовательно, масса изотопа углерода-12 равна 12 единицам атомной массы (u).
Таким же образом можно определить массы других изотопов химических элементов, зная число протонов и нейтронов в ядре. Это позволяет уточнять массу атомов при проведении различных физических и химических исследований.
Методы анализа массы
Существует несколько методов, которые позволяют определить массу изотопа с высокой точностью. Ниже перечислены некоторые из них:
- Масс-спектрометрия. Этот метод основан на разделении ионов различной массы в магнитном поле. Он позволяет измерять массу изотопа с большой точностью.
- Атомная силовая микроскопия. Этот метод использует зонд, который сканирует поверхность образца, измеряя силы, действующие между зондом и атомами. Он применяется для изучения массы и размеров атомов.
- Рентгеноструктурный анализ. Этот метод основан на рассеянии рентгеновских лучей кристаллами. Он позволяет измерить массу изотопа, определить его положение в структуре кристалла и рассчитать его расстояния и углы.
Каждый из этих методов имеет свои преимущества и ограничения. При выборе метода для анализа массы изотопа необходимо учитывать его точность, доступность и возможность применения в конкретной ситуации.
Применение полученных данных

Используя закон сохранения массового числа и данные, полученные при определении массы изотопа, можно провести ряд различных расчетов и исследований.
Во-первых, зная массу изотопа, можно рассчитать его относительную атомную массу. Для этого необходимо знать массу других изотопов данного элемента и их соотношение в природе. Расчет относительной атомной массы позволяет установить тип изотопа (стабильный или радиоактивный) и его распространенность.
Во-вторых, полученные данные по массе изотопа могут быть использованы для подтверждения синтеза новых элементов в лабораторных условиях. Если синтезированный элемент имеет определенную массу, совпадающую с массой изотопа, то это свидетельствует о его существовании и подтверждает теорию о синтезе новых элементов.
Также, зная массу изотопа, можно провести расчеты связанные с радиоактивным распадом. По массе изотопа можно рассчитать его полураспадный период, скорость распада и другие характеристики радиоактивного процесса.
Таким образом, данные, полученные при определении массы изотопа по закону сохранения массового числа, могут быть использованы для различных исследований и расчетов, связанных с химическими и физическими свойствами изотопов.