Масса атома - одно из основных понятий в физике, которое помогает нам понять, как устроена материя. Масса атома определяет его инертность и влияет на его поведение в химических реакциях. Но как же найти массу атома и что она обозначает?
Масса атома измеряется в атомных единицах массы (а.е.м.) или делями массы атома водорода. Каждый элемент имеет свою уникальную массу атома, которая пропорциональна числу протонов и нейтронов в его ядре. Но как узнать количество протонов и нейтронов в атоме?
Оказывается, что количество протонов в атоме равно атомному номеру элемента, который указан на таблице Менделеева. Например, у водорода атомный номер равен 1, а значит, в его ядре находится 1 протон. Количество нейтронов в атоме можно узнать, вычтя из массового числа (указывается также на таблице Менделеева) атомный номер. Таким образом, мы можем найти массу атома элемента и рассчитать его относительную атомную массу.
Что такое масса атома

Масса атома определяется числом нуклонов, которые входят в его состав. Нуклоны в атоме могут быть протонами и нейтронами, которые образуют ядро атома. Более того, протоны и нейтроны имеют практически одинаковую массу, поэтому масса атома определяется преимущественно массой нуклонов.
Масса атома может быть представлена как сумма массы протонов и нейтронов, умноженных на их количества в атоме. Таким образом, чтобы найти массу атома, необходимо знать количество протонов и нейтронов, образующих его ядро.
Масса атома имеет большое значение в различных областях науки, таких как химия и физика ядра. Она позволяет определить молекулярную массу вещества, производить расчеты энергетических процессов и прогнозировать свойства вещества.
Определение и значение

Масса атома измеряется в атомных единицах массы (ЕМ), которая равна примерно 1,66 × 10-27 килограмма. Масса атома обозначается символом М.
Значение массы атома может различаться для разных элементов. Например, масса атома водорода равна примерно 1 ЕМ, тогда как масса атома кислорода составляет примерно 16 ЕМ. Эти значения являются средними массами атомов в природе, так как встречаются атомы с разным числом нейтронов в ядре.
Знание масс атомов позволяет проводить различные расчеты в химии, физике и других науках. Оно помогает устанавливать соотношения между реагентами и продуктами химических реакций, а также оценивать энергию связей между атомами в молекулах.
Таким образом, понимание массы атома имеет важное значение для построения научных моделей и объяснения явлений в мире микромасштаба.
Методы определения массы атома

- Массовый спектрометр: этот метод основан на использовании электромагнитного поля для измерения массы атома. Атомы пропускаются через гусеничный полярографический ионный замок, где они ионизируются и затем разделяются в массовом спектрометре. Массовый спектрометр измеряет отношение заряда к массе (q/m) и позволяет определить массу атома.
- Изотопический анализ: этот метод основан на измерении относительного содержания изотопов определенного элемента. Изотопы - это атомы одного элемента с одинаковым числом протонов, но разным числом нейтронов. Изотопический анализ позволяет вычислить среднюю массу атома, учитывая веса всех изотопов и их относительные концентрации.
- Массовая спектрометрия с радиоактивными изотопами: этот метод основан на использовании радиоактивных изотопов. Атомы радиоактивных изотопов ионизируются и пропускаются через массовый анализатор, который разделяет их по массе. После разделения масса атома может быть измерена с помощью детектора.
Определение массы атома является сложной и точной задачей, и каждый из этих методов имеет свои преимущества и ограничения. Однако, благодаря этим методам, ученые смогли получить точные данные о массе атомов различных элементов, что позволяет лучше понять структуру и свойства вещества.
Метод натрия и калия

Для проведения опыта по методу натрия и калия необходимо взять две маленьких металлических фольги – одну из натрия и одну из калия. Затем, при помощи специального устройства, которое создает заряд, фольги заряжаются положительно. После этого они приближаются друг к другу с определенной скоростью.
В результате приближения заряженных фольг друг к другу, происходит отталкивание их между собой. При этом сила электростатического отталкивания зависит от заряда фольг и расстояния между ними. С помощью специальных измерительных приборов определяется сила отталкивания, которая в свою очередь позволяет вычислить массу атома.
Этот метод основан на известной формуле Фарадея для расчета силы электростатического отталкивания между двумя точечными зарядами. Формула выглядит следующим образом:
F = k * (Q1 * Q2) / r^2
Где:
- F – сила электростатического отталкивания
- k – постоянная Кулона
- Q1, Q2 – заряды фольг натрия и калия
- r – расстояние между фольгами
Полученное значение силы позволяет определить массу атома натрия и калия путем использования закона сохранения импульса и закона сохранения энергии.
Таким образом, метод натрия и калия является простым и эффективным способом определения массы атома в физике и химии, который основан на изучении электростатической отталкивающей силы между заряженными частицами.
Метод фотографической пластинки

Принцип работы метода заключается в следующем:
- Пластинка фотоэмульсии состоит из слоя чувствительной эмульсии, нанесенной на подложку из стекла или пластика.
- Под действием взаимодействия частиц с атомами в эмульсии возникают треки. Эти треки представляют собой серебряную микрочастицу, образованную в результате химической реакции.
- После некоторого времени экспозиции фотоэмульсии пластинка развивается – химический процесс, в результате которого серебряные микрочастицы видны глазом или под микроскопом.
- Измеряя треки частиц на пластинке, можно определить их энергию и массу, а также провести дальнейшие исследования.
Метод фотографической пластинки широко применяется в ядерной физике и позволяет исследовать взаимодействие частиц на атомарном уровне. Он играет важную роль в различных физических исследованиях и является одним из основных инструментов для изучения свойств и структуры атома и его составляющих.
| Плюсы метода фотографической пластинки | Минусы метода фотографической пластинки |
|---|---|
|
|
Формула расчета массы атома

Для расчета массы атома первоначально необходимо узнать число нуклонов в атому, то есть число его протонов и нейтронов. Протоны и нейтроны имеют примерно одинаковую массу, поэтому сумму числа протонов и числа нейтронов можно считать числом нуклонов.
Затем следует узнать номер химического элемента (или атомного номера), который показывает число протонов в ядре атома. Это число обозначается символом Z.
Формула для расчета массы атома выглядит следующим образом:
- Масса атома = (число нуклонов - число протонов) × (масса нуклона)
Где масса нуклона равна 1 аму.
Например, для атома углерода (С) химический элемент имеет атомный номер 6, а число нуклонов составляет примерно 12.
- Масса атома углерода = (12 - 6) × 1 аму
- Масса атома углерода = 6 аму
Таким образом, масса атома углерода составляет 6 атомных единиц массы (аму).
Простейшее объяснение формулы

Формула для нахождения массы атома может быть представлена следующим образом:
| Символ | Обозначение |
|---|---|
| A | массовое число атома |
| Z | атомный номер атома |
| X | символ химического элемента |
Масса атома вычисляется по следующей формуле:
M(атом) = A ∙ узл
где A - массовое число атома, Z - атомный номер атома, X - символ химического элемента, а узл - доля массы протона.
Таким образом, для нахождения массы атома, необходимо знать его массовое число и атомный номер, а также узл - долю массы протона.
Примеры задач по нахождению массы атома
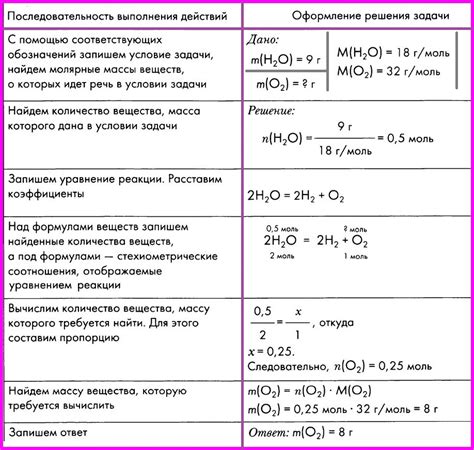
Для того чтобы лучше понять, как находить массу атома, рассмотрим несколько примеров задач:
- Задача 1: Найти массу атома кислорода. Известно, что атом кислорода имеет 8 протонов, 8 нейтронов и 8 электронов. Чтобы найти массу атома, нужно сложить количество протонов и нейтронов в атоме. Таким образом, масса атома кислорода равна 8 + 8 = 16 единиц массы атома (u).
- Задача 2: Найти массу атома алюминия. Известно, что атом алюминия имеет 13 протонов, 14 нейтронов и 13 электронов. Сложим количество протонов и нейтронов: 13 + 14 = 27 единиц массы атома (u). Таким образом, масса атома алюминия равна 27 универсальным атомным массам.
- Задача 3: Найти массу атома углерода. Известно, что атом углерода имеет 6 протонов, 6 нейтронов и 6 электронов. Просуммируем количество протонов и нейтронов: 6 + 6 = 12 единиц массы атома (u). Таким образом, масса атома углерода равна 12 универсальным атомным массам.
Используя эти примеры задач, можно лучше понять, как найти массу атома, зная его состав.