Титрование – это метод определения концентрации химического вещества путем реакции его с раствором известного концентрационного значения. Одной из самых распространенных реакций, используемых при титровании, является реакция соляной кислоты с щелочью. Определение концентрации соляной кислоты может быть полезным во многих лабораторных и промышленных процессах. В этой статье мы представим вам инструкцию и методику об определении концентрации соляной кислоты при титровании.
Для определения концентрации соляной кислоты мы будем использовать раствор щелочи, известной концентрации. Перед началом эксперимента необходимо приготовить растворы обеих реагентов и проверить их точность с помощью калибровочных растворов. Важным этапом является подготовка бюретки – стеклянной емкости с краном, которая будет содержать раствор щелочи.
Далее проводится титрование – медленное добавление раствора щелочи из бюретки в пробирку с соляной кислотой. Во время титрования необходимо периодически подмешивать раствор в пробирке и обратить внимание на изменение цвета. Когда цвет пробирки изменится менее различимо, следует прислушаться к звуку, издаваемому бюреткой при каплировании щелочи, и остановить подачу раствора щелочи, когда звук прекратится.
Поскольку мы знаем концентрацию щелочи, а также объем использованного раствора щелочи, мы можем рассчитать концентрацию соляной кислоты, используя химическое уравнение реакции и закон сохранения массы. Эта информация может быть полезной при проведении экспериментов или в промышленных процессах, требующих определения концентрации соляной кислоты.
Определение концентрации соляной кислоты при титровании: инструкция и методика

Соляная кислота (HCl) является одним из наиболее распространенных реагентов для титрования. Она широко используется в химических лабораториях для анализа содержания оснований и других растворимых веществ.
Для определения концентрации соляной кислоты, вам понадобятся следующие ингредиенты и оборудование:
- Соляная кислота неизвестной концентрации.
- Реагент, способный реагировать с соляной кислотой. Хорошим выбором является раствор натрия гидроксида (NaOH) известной концентрации.
- Фенолфталеин - индикатор, который меняет свой цвет при достижении эквивалентной точки, т.е. когда стехиометрическое соотношение между кислотой и основанием достигнуто.
- Мерный колба или штатив с бюреткой для точного измерения объемов реагентов.
Инструкция по определению концентрации соляной кислоты:
- Подготовьте раствор натрия гидроксида (NaOH) известной концентрации, используя точное взвешивание и разведение реагента в дистиллированной воде.
- Используя мерную колбу или штатив с бюреткой, измерьте определенное количество соляной кислоты неизвестной концентрации.
- Добавьте несколько капель фенолфталеина в колбу с соляной кислотой.
- Медленно титруйте соляную кислоту раствором натрия гидроксида до появления устойчивого розового цвета. Это будет указывать на достижение эквивалентной точки.
- Запишите объем раствора натрия гидроксида, который был использован для достижения эквивалентной точки.
- По стехиометрическому соотношению между соляной кислотой и натрием гидроксидом рассчитайте концентрацию соляной кислоты в единицах молярности или процентах.
Важно помнить, что точность определения концентрации соляной кислоты при титровании зависит от правильного измерения объемов реагентов и соблюдения всех необходимых мер предосторожности.
Используйте эту инструкцию и методику для определения концентрации соляной кислоты при титровании и получения точных результатов в химической лаборатории.
Подготовка оборудования к определению концентрации соляной кислоты

Перед проведением титрования необходимо тщательно подготовить оборудование, чтобы получить точные и достоверные результаты. Вот список необходимого оборудования для определения концентрации соляной кислоты:
| № | Наименование оборудования | Описание |
|---|---|---|
| 1 | Аналитические весы | Используются для взвешивания порций реагентов с точностью до 0,1 мг. |
| 2 | Мерный цилиндр | Используется для измерения объема растворов с точностью до 0,1 мл. |
| 3 | Бюретка | Точная мерная емкость с краном, используется для отмеривания точного объема раствора для титрования. |
| 4 | Стакан | Используется для приготовления и разведения растворов. |
| 5 | Фенолфталеин | Индикатор, меняющий цвет в зависимости от pH раствора, используется для визуального определения концентрации соляной кислоты. |
| 6 | Соляная кислота | Реагент, который будет титроваться. |
| 7 | Раствор щелочи | Титрант, раствор щелочи с известной концентрацией, используется для нейтрализации соляной кислоты. |
| 8 | Индикаторный раствор | Раствор с индикатором, используется для визуального определения точного конца титрования. |
Помимо указанного оборудования также необходимы перчатки, защитные очки и фартук для обеспечения безопасности.
Проведение титрования с использованием индикатора
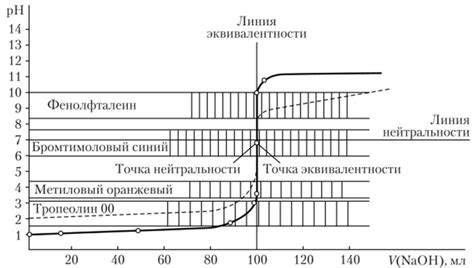
Для начала необходимо приготовить раствор соляной кислоты с неизвестной концентрацией. Для этого измерьте 5-10 мл кислоты, перенесите ее в чистую колбу емкостью 250 мл и добавьте дистиллированную воду до метки на горлышке. Теперь можно приступать к самому титрованию.
Сначала необходимо приготовить раствор щелочи с известной концентрацией. Для этого измерьте 10-20 мл раствора щелочи (например, NaOH) с известной концентрацией, а затем разбавьте его в колбе до нужного объема дистиллированной водой.
Полученный раствор щелочи (титр-раствор) следует перелить в бюретку. Затем следует добавить капли фенолфталеина в колбу с раствором соляной кислоты – цвет раствора станет кислым (проявится розовый или красный цвет). Затем начните медленно подливать титр-раствор щелочи из бюретки в колбу со соляной кислотой, постоянно перемешивая раствор. Когда цвет раствора изменится с красного на безцветный, значит титрование завершено.
Определите объем титр-раствора щелочи, который был использован для нейтрализации соляной кислоты. Затем можно воспользоваться следующей формулой для определения концентрации соляной кислоты:
| Объем титр-раствора щелочи (мл) | × | Концентрация щелочи (моль/л) | = | Объем соляной кислоты (мл) | × | Концентрация соляной кислоты (моль/л) |
Зная объем титр-раствора щелочи и его концентрацию, а также объем соляной кислоты искомого раствора, можно рассчитать концентрацию соляной кислоты при титровании.
Расчет концентрации соляной кислоты на основе результатов титрования
После завершения процедуры титрования необходимо провести расчет концентрации соляной кислоты на основе полученных результатов. Для этого следует использовать простую формулу, которая учитывает объем и концентрацию щелочи, использованной для тритрования соляной кислоты.
Первым шагом в расчете концентрации является определение эквивалентной точки титрования, которая обозначает точку, в которой реагенты полностью реагируют между собой. Эта точка достигается тогда, когда количество добавленной щелочи соответствует количеству соляной кислоты.
Для определения эквивалентной точки обычно используется индикатор, который меняет цвет в присутствии избытка соляной кислоты либо щелочи. Когда цвет индикатора меняется, это указывает на достижение эквивалентной точки.
Затем следует измерить объем щелочи, необходимый для достижения эквивалентной точки. Этот объем обычно измеряется в миллилитрах (мл) и обозначается V1.
Для расчета концентрации соляной кислоты можно использовать следующую формулу:
C(HCl) = (C(NaOH) * V1) / V2
Где:
- C(HCl) - концентрация соляной кислоты;
- C(NaOH) - концентрация щелочи (натриевой гидроксида);
- V1 - объем щелочи, необходимый для достижения эквивалентной точки;
- V2 - объем соляной кислоты, взятой для титрования.
Подставив значения в указанную формулу, можно получить концентрацию соляной кислоты. Обратите внимание, что значения концентрации следует указывать в одних и тех же единицах (обычно молях налогового показателя), а объемы в миллилитрах.
Расчет концентрации соляной кислоты на основе результатов титрования может быть полезным при проведении химических экспериментов и контроле качества продукции. Точность измерений зависит от правильного выполнения титрования и точности использованных инструментов и реагентов.
Определение погрешности измерений и контроль качества результатов

При проведении титрования и определении концентрации соляной кислоты необходимо учитывать возможные погрешности измерений и обеспечивать контроль качества результатов. Это поможет увеличить точность и надежность получаемых данных.
Одной из основных погрешностей при титровании является погрешность объема переносимой жидкости. Для уменьшения этой погрешности рекомендуется использовать точное либо калиброванное стеклянное сосуд для измерения объема раствора. Также следует точно отмерять объем дозируемой реакционной смеси с помощью пипеток или бюреток.
Другой важный источник погрешности – погрешность измерения показателей. Например, погрешность измерения конечной точки, которая определяется визуально (изменение цвета). Для уменьшения этой погрешности рекомендуется повторять титрование несколько раз и усреднять полученные значения.
Кроме того, контроль качества результатов может быть обеспечен с помощью использования стандартных растворов с известной концентрацией соляной кислоты. Такие растворы могут быть приобретены в специализированных химических компаниях и используются для калибровки методики титрования.
Важно также следить за условиями проведения титрования, чтобы минимизировать влияние внешних факторов. Например, температура растворов должна быть стабильной и соответствовать указанным в методике требованиям. Также следует обеспечить правильное перемешивание реакционной смеси и точное добавление реагента.
И наконец, стоит уделить внимание правильной обработке и анализу полученных результатов. Расчет концентрации соляной кислоты проводится с учетом объема и концентрации титранта, V и C, а также объема и концентрации пробы соляной кислоты, V1 и C1. При расчете необходимо точно соблюдать формулу и учитывать все факторы, которые могут влиять на точность и надежность получаемых данных.
Таким образом, определение погрешности измерений и контроль качества результатов являются важными этапами при титровании и определении концентрации соляной кислоты. Соблюдение этих этапов поможет получить более точные и достоверные значения концентрации и обеспечит надежность полученных результатов.