В этой статье мы рассмотрим, как найти давление газа в сосуде. Для начала, необходимо понять, что давление газа связано с двумя основными факторами - объемом сосуда и количеством газа внутри. Когда объем сосуда увеличивается, давление газа внутри снижается, а при уменьшении объема - давление увеличивается. Это называется законом Бойля-Мариотта.
Найти давление газа можно с помощью формулы, которая называется уравнением состояния идеального газа. Это уравнение связывает давление газа, объем, температуру и количество вещества. Уравнение состояния идеального газа выглядит следующим образом: P * V = n * R * T, где P - давление газа, V - объем сосуда, n - количество вещества газа, R - универсальная газовая постоянная, T - температура в градусах Кельвина.
Чтобы найти давление газа, необходимо знать значения остальных величин в уравнении состояния идеального газа. Объем сосуда можно измерить с помощью специальных инструментов, таких как мерная колба или цилиндр. Количество вещества газа можно определить с помощью химической формулы вещества и его молярной массы.
Температуру в градусах Кельвина можно измерить с помощью термометра и преобразовать из градусов Цельсия с помощью соотношения T(K) = T(°C) + 273.15. Подставив все известные значения в уравнение состояния идеального газа, можно найти давление газа в сосуде.
Определение давления в газовом состоянии
Для определения давления газа необходимо использовать уравнение состояния идеального газа, которое записывается следующим образом:
PV = nRT
где:
- P - давление газа (в Па или Н/м²)
- V - объем газа (в м³)
- n - количество вещества газа (в молях)
- R - универсальная газовая постоянная (около 8,314 Дж/(моль·К))
- T - температура газа (в Кельвинах)
Зная значения всех параметров в уравнении, можно легко вычислить давление газа в сосуде. Например, если известны объем газа, количество вещества и температура, можно выразить давление следующим образом:
P = (nRT) / V
Важно отметить, что данное уравнение действительно только для идеальных газов, которые следуют газовому закону. В реальности давление газа также зависит от других факторов, таких как взаимодействие молекул и влияние других частей сосуда, но для простого определения давления в школьных условиях это уравнение будет достаточным.
Подводя итог, определение давления газа в сосуде возможно с использованием уравнения состояния идеального газа, которое связывает давление, объем, количество вещества и температуру газа. Зная значения этих параметров, можно легко вычислить давление газа в сосуде.
Влияние объема газа на давление

Это явление можно проиллюстрировать с помощью примера с шариком и насосом. Если мы накачаем воздух в шарик с помощью насоса, то шарик будет надуваться и его объем будет увеличиваться. При этом давление воздуха внутри шарика будет увеличиваться. Если мы, наоборот, начнем выпускать воздух из шарика, его объем будет уменьшаться, а давление воздуха внутри шарика – уменьшаться.
Такое поведение газа объясняется кинетической теорией газов. Согласно данной теории, газ состоит из молекул, которые не прекращают движение. При изменении объема сосуда молекулы газа могут взаимодействовать или сталкиваться друг с другом и со стенками сосуда. При увеличении объема, молекулы имеют больше свободы для движения, и вероятность столкновения молекул между собой и со стенками сосуда снижается. Поэтому давление газа в сосуде уменьшается. При уменьшении объема, молекулы газа оказываются ближе друг к другу и сталкиваются чаще, что приводит к увеличению давления газа.
Таким образом, меняя объем газа в сосуде, можно изменять его давление. Это явление широко используется в различных областях, например в технике, воздушных шарах и даже в легковых автомобилях, где изменение давления в шинах позволяет увеличить или уменьшить сцепление с дорогой.
Роль температуры при измерении давления газа

Температура играет важную роль при измерении давления газа в сосуде. Изучение этого взаимоотношения помогает нам понять, как температура влияет на свойства газов и их поведение в закрытых системах.
В соответствии с законом Гая-Люссака, давление газа прямо пропорционально его абсолютной температуре при постоянном объеме и постоянном количестве вещества. Это означает, что при увеличении температуры газа, его давление также возрастает, а при уменьшении температуры - снижается.
Для измерения давления газа в сосуде необходимо учитывать и контролировать его температуру. Это объясняется тем, что изменение температуры может привести к неправильным или неточным результатам измерений. Поэтому при проведении экспериментов и измерений давления газа важно обеспечить постоянные условия температуры.
Различные элементы и приборы, используемые для измерения давления газа, такие как манометры и барометры, обычно включают компенсационные устройства для учета температурных изменений. Это позволяет получить более точные и надежные результаты измерений.
Таким образом, понимание роли температуры при измерении давления газа помогает нам улучшить точность и надежность получаемых результатов. Обеспечение постоянных условий температуры является важным аспектом при работе с газовыми системами и при проведении экспериментов, где необходимо измерить давление газа в сосуде.
Закон Бойля-Мариотта и его значение для расчетов давления

Закон Бойля-Мариотта, или закон давления газов, устанавливает важную связь между давлением, объемом и температурой газа. Согласно этому закону, при неизменной температуре объем газа изменяется обратно пропорционально его давлению. Другими словами, если объем газа уменьшается, то давление газа увеличивается, и наоборот.
Закон Бойля-Мариотта применяется для расчетов давления газа в различных ситуациях. Например, при сжатии или расширении газа в сосуде. Это позволяет определить, как изменится давление газа при изменении его объема. Для этого можно использовать формулу закона Бойля-Мариотта:
| Исходные данные | Результаты |
|---|---|
| Давление 1 (P1) | Давление 2 (P2) |
| Объем 1 (V1) | Объем 2 (V2) |
Где P1 и V1 - исходные значения давления и объема, P2 и V2 - конечные значения давления и объема.
Следуя этой формуле, можно легко рассчитать давление газа при изменении его объема, если известны начальные и конечные значения давления и объема.
Закон Бойля-Мариотта имеет большое значение в науке и технике. Он используется в газовой динамике, химии, физике и других областях. Знание этого закона позволяет предсказать поведение газов и применять их в различных технических процессах, таких как сжатие газов в цилиндрах, работа турбин и компрессоров, и многое другое.
Как использовать манометр для измерения давления газа

Для начала, необходимо подключить манометр к сосуду, в котором находится газ. Для этого важно обратить внимание на указания производителя по установке и подключению манометра. Обычно для этого используется соединительный шланг или трубка.
Когда манометр правильно подключен, его показания можно считывать. Обратите внимание на шкалу манометра, которая обычно разделена на единицы измерения давления, например, паскали (Па) или атмосферы (атм). Как правило, манометры могут быть аналоговыми или цифровыми, поэтому чтение показаний может немного различаться в зависимости от типа манометра.
Чтобы получить точные показания, важно установить единицы измерения давления, которые использует манометр. Если манометр имеет возможность выбора единиц измерения, установите подходящие для вас. Это может быть паскали, атмосферы или другие единицы измерения.
Когда манометр настроен и подключен, можно начинать измерение. Для этого следует убедиться, что манометр и система находятся в статическом состоянии - то есть давление в системе не меняется. Затем можно считывать показания манометра и записывать их для последующего анализа или использования в расчетах.
Важно помнить, что манометр измеряет только давление газа в сосуде, к которому он подключен. Если необходимо измерить давление в различных точках системы, возможно, потребуется использовать несколько манометров или перемещать один манометр по системе.
Способы определить давление газа без манометра
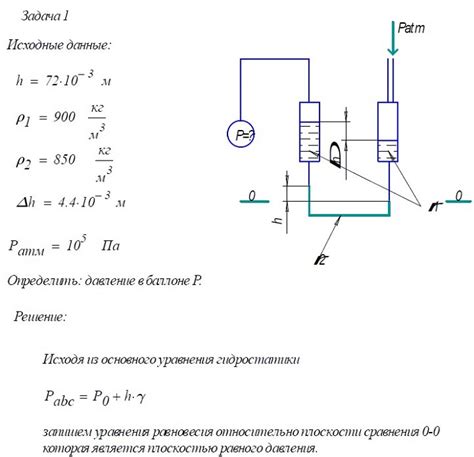
Иногда возникает ситуация, когда нужно определить давление газа в сосуде, но при этом нет манометра или другого специального оборудования. В таких случаях можно использовать другие методы и простые приближенные способы для определения давления. Ниже приведены несколько таких способов:
- Метод с сосудом с водой - для этого метода понадобится стеклянный сосуд с водой и герметичная пробка. Сначала сосуд нужно наполнить водой и закрыть пробкой. Затем нужно подвесить сосуд за пробку таким образом, чтобы он мог свободно колебаться. Далее, сосуд нужно нагреть, например, прикладывая к нему огонь. При нагревании, давление внутри сосуда увеличивается, и сосуд начинает колебаться. По амплитуде и частоте колебаний можно примерно определить давление газа внутри сосуда.
- Метод с использованием баллона - для этого метода понадобится небольшой резиновый баллон и проницаемый шарик (например, шарик от игрушки). Сначала нужно заполнить баллон газом, например, надувая его ртом. Затем нужно прикрепить шарик к отверстию баллона таким образом, чтобы он закрывал его плотно. Далее, можно нажать на баллон и заметить, как сжимается шарик. По степени сжатия шарика можно приближенно определить давление газа внутри баллона.
- Метод с использованием сжатой пружины - для этого метода понадобится пружина с известной жесткостью и предмет, способный сдавить эту пружину. Сначала нужно прижать предмет к пружине, чтобы она была сжата на определенную длину. Затем, приложив известную силу к предмету, можно измерить новую длину сжатой пружины. По изменению длины пружины можно примерно определить изменение давления газа.
Несмотря на то, что эти методы не дают точных результатов, они могут быть полезны при отсутствии специального оборудования для измерения давления газа. Однако, для получения точных данных рекомендуется использовать манометр или другое специальное оборудование.
Формулы и примеры расчета давления газа в сосуде

Давление газа в сосуде можно рассчитать с использованием нескольких формул, основанных на законах физики:
Закон Бойля-Мариотта (pV = const)
Согласно этому закону, для идеального газа давление и объем обратно пропорциональны друг другу при постоянной температуре. Формула для расчета давления в этом случае выглядит следующим образом:
p1 * V1 = p2 * V2
где p1 и V1 - первоначальное давление и объем газа, а p2 и V2 - конечное давление и объем газа.
Например, если начальное давление газа в сосуде составляет 2 атмосферы, а его объем равен 5 литров, а после увеличения объема его давление уменьшилось до 1 атмосферы, можно расчитать новый объем по формуле:
2 * 5 = 1 * V2
V2 = 10 литров
Таким образом, после увеличения объема газа до 10 литров его давление будет составлять 1 атмосферу.
Закон Гей-Люссака (p/T = const)
Согласно этому закону, для идеального газа давление и температура прямо пропорциональны друг другу при постоянном объеме. Формула для расчета давления в этом случае выглядит следующим образом:
p1 / T1 = p2 / T2
где p1 и T1 - первоначальное давление и температура газа, а p2 и T2 - конечное давление и температура газа.
Например, если начальное давление газа в сосуде составляет 3 атмосферы, а его температура равна 300 Кельвинов, а после повышения температуры его давление увеличилось до 4 атмосфер, можно расчитать новую температуру по формуле:
3 / 300 = 4 / T2
T2 = 400 Кельвинов
Таким образом, после повышения температуры газа до 400 Кельвинов его давление будет составлять 4 атмосферы.
Это лишь два примера из множества формул и законов, позволяющих расчитывать давление газа в сосуде. Различные факторы, такие как объем, температура и количество частиц газа, могут влиять на давление. Понимание этих формул поможет вам проводить расчеты и решать задачи, связанные с давлением газа в различных ситуациях.