В химии одной из основных концепций является понятие электронных пар. Знание того, как найти электронные пары, является фундаментальным для понимания химических связей и структуры молекул. В этом пошаговом руководстве мы рассмотрим различные способы определения и обнаружения электронных пар в химических соединениях.
Электронные пары - это пары электронов, находящихся внутри атома или между атомами в молекуле. Они играют важную роль в формировании химических связей и определяют геометрию молекулы. Существует несколько основных способов определения электронных пар, включая модели Льюиса, теорию Вальенса-Браунфильда и теорию Вальенса.
Модель Льюиса основана на представлении атомов в виде ядра и окружающих его электронов. При использовании модели Льюиса электронные пары обычно обозначаются точками или чертами, которые указывают на наличие свободных электронных пар или связей между атомами. Это позволяет наглядно представить структуру молекулы и определить электронные пары, связи и несвязанные электроны.
Теория Вальенса-Браунфильда рассматривает электронные пары как совместно используемые парами электронов, которые имеют общее электронное облако. Она основана на предположении, что электронные пары образуют связи между атомами и помогают объяснить химические свойства соединений. Эта теория позволяет определить положение и количество электронных пар в молекуле и прогнозировать ее форму.
Определение электронных пар
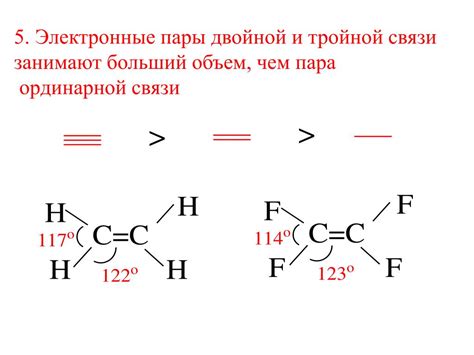
Валентные электроны, находящиеся на внешнем энергетическом уровне атома, участвуют в образовании электронных пар. При образовании ковалентной связи два атома делят свои электроны, образуя электронные пары.
Электронные пары можно образовать как между атомами одного элемента, так и между атомами разных элементов. Обычно электронные пары располагаются вокруг центрального атома и формируют геометрическую структуру молекулы.
Одноэлектронные пары представляют собой одиночные электроны, которые не участвуют в образовании химических связей. Они находятся на несвязанных энергетических уровнях атомов и могут быть заняты только одним электроном.
Двухэлектронные пары представляют собой пары электронов, которые делятся между двумя атомами при образовании двойной или тройной ковалентной связи.
Изучение электронных пар позволяет понять структуру и свойства молекул и применить это знание в различных областях химии, таких как органическая и неорганическая химия, химия материалов и биохимия.
Значение электронных пар в химических реакциях
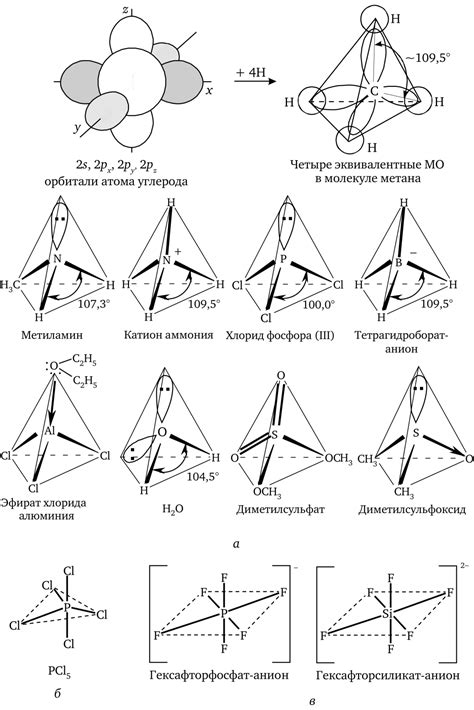
Электронные пары играют важную роль в химических реакциях, так как они определяют химическую связь между атомами в молекуле. Электронные пары располагаются вокруг атомов и могут быть общими (содержаться между двумя атомами) или непарными (присутствовать только на одном атому).
Общие электронные пары, также известные как связывающие пары, создают химическую связь между атомами. Они участвуют в образовании ковалентных связей, где два атома делают обмен электронами, чтобы достичь стабильной электронной конфигурации. Общие электронные пары создают молекулярные орбитали и являются основой для формирования молекулярной структуры и свойств соединения.
Непарные электронные пары, также известные как несвязывающие пары или остаточные пары, не участвуют в создании химической связи, но они оказывают влияние на геометрию молекулы. Непарные электронные пары могут отталкиваться друг от друга, вызывая изменение углов связи и приводя к изменению формы и структуры молекулы.
Важно понимать значение электронных пар при определении химических свойств и поведения веществ. Анализ электронных пар помогает предсказывать степень реакционной активности соединений и способствует пониманию реакционных механизмов.
Способы определения электронных пар
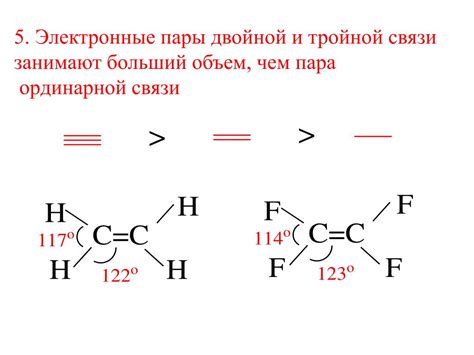
1. Формальный заряд
Один из способов определить количество электронных пар на атоме - это расчет формального заряда. Формальный заряд атома может быть положительным, отрицательным или нулевым. Если атом имеет положительный формальный заряд, то он теряет электронные пары; если он имеет отрицательный формальный заряд, то он получает дополнительные электронные пары. Нулевый формальный заряд говорит о том, что атом не теряет и не получает электронные пары.
2. Строение Льюиса
Другой способ определить электронные пары - это использование строения Льюиса. Строение Льюиса показывает, какие атомы связаны между собой и какие электронные пары находятся около каждого атома. Нарисуйте атомы в центре страницы и обозначьте за каждым из них его символом. Затем нарисуйте точки, представляющие электронные пары, вокруг каждого атома. Количество электронных пар определит структуру и связи между атомами.
3. Анализ геометрии молекулы
Третий способ определить электронные пары - это анализ геометрии молекулы. В молекуле электронные пары распределяются таким образом, чтобы минимизировать отталкивание между ними. Некоторые структуры молекул имеют распределение электронных пар, которое можно проследить по их геометрической форме. Например, молекула с общей формулой AB2 имеет линейную геометрию, где две электронные пары находятся напротив друг друга. Изучение геометрии молекулы поможет определить количество электронных пар на каждом атоме.
Поиск электронных пар в различных соединениях
Когда мы исследуем химические соединения, важно понять, какие атомы связаны друг с другом и как распределены их электронные пары. Электронные пары могут играть ключевую роль в химических реакциях и определять свойства соединения.
Существует несколько методов для определения электронных пар в различных соединениях. Один из самых распространенных методов - использование модели Вальенса. Эта модель предполагает, что валентные электроны атомов создают электронные пары, которые влияют на их связывание с другими атомами. В модели Вальенса каждая электронная пара обозначается линией или парой точек между атомами.
Однако в некоторых случаях электронные пары могут быть неявно представлены, например, в связях между атомами алкинов или ароматических соединений. В таких случаях мы можем использовать эмпирические правила для определения электронных пар.
Если атом образует одинарную связь с другим атомом, он вносит одну электронную пару. Если атом образует двойную связь, он вносит две электронные пары, а если атом образует тройную связь, он вносит три электронные пары.
Другой метод определения электронных пар - использование формального заряда. Формальный заряд атома может быть положительным или отрицательным и указывает, сколько электронных пар принадлежит этому атому. Если у атома положительный формальный заряд, это означает, что он потерял электронную пару. Если у атома отрицательный формальный заряд, это означает, что он приобрел дополнительную электронную пару.
Таким образом, при поиске электронных пар в различных соединениях мы можем использовать модель Вальенса, эмпирические правила или формальный заряд атомов. Это поможет нам лучше понять структуру соединения и его химические свойства.
Применение знаний о электронных парах в химической практике

Понимание электронных пар и их распределения в молекулах играет важную роль в химической практике. Знание, как найти электронные пары и определить их количество, помогает предсказать и объяснить химические свойства веществ и реакций.
Одно из применений знаний о электронных парах - предсказание геометрии молекулы. Зная количество электронных пар вокруг центрального атома, можно определить его гибридизацию и пространственную ориентацию связей. Например, если у центрального атома есть две электронные пары и две связи, можно предсказать, что он имеет гибридизацию sp2 и плоскую треугольную форму молекулы.
Другим применением знаний о электронных парах является объяснение химической активности веществ. Электронные пары могут участвовать в различных типах химических связей и реакциях. Например, электронная пара валентной оболочки кислорода может образовывать ковалентную связь с водородом, образуя молекулу воды.
Кроме того, понимание электронных пар позволяет предсказывать положение и поведение реагентов в реакциях. Например, если известно, что в молекуле вещества есть электронные пары, можно предсказать, где произойдет атака нуклеофила или электрофила.