В химических соединениях электронные пары играют важную роль, определяя их свойства и реакционную способность. Поэтому, для понимания и предсказания поведения молекул и соединений, необходимо знать методы поиска и определения электронных пар.
Одним из методов поиска электронных пар является визуализация молекулярной структуры с помощью специальных программных инструментов. Это позволяет наглядно представить атомы и связи между ними, а также электронные облака, содержащие электронные пары. Такой подход особенно полезен при работе с сложными органическими соединениями.
Другим методом поиска электронных пар является использование теоретических расчетов, основанных на квантовомеханических принципах. С их помощью можно определить положение и характер электронных пар в молекуле, а также прогнозировать их поведение в реакциях. Такие расчеты позволяют получить подробную информацию о молекулярной структуре и свойствах соединения.
Понятие электронной пары
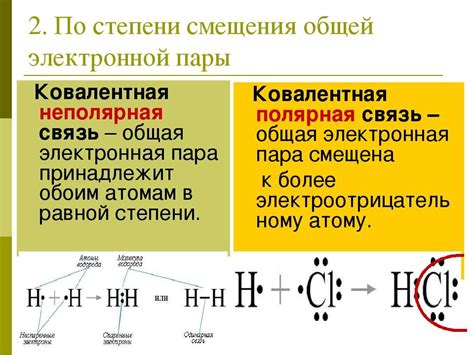
Валентные электроны могут участвовать в химических реакциях и образовывать химические связи с другими атомами. Электронные пары, образующиеся при образовании химической связи между двумя атомами, называются связующими электронными парами. Они являются основой для формирования химических соединений.
Связующие электронные пары играют важную роль в определении геометрии молекулы и свойств химических соединений. Они могут образовывать одинарные, двойные или тройные связи между атомами, а также присутствовать в виде несвязывающих электронных пар, которые не участвуют в образовании связей.
Понимание понятия электронной пары основополагающее для изучения строения и свойств химических соединений, а также для прогнозирования и предсказания химических реакций и превращений.
Роль электронных пар в химических соединениях
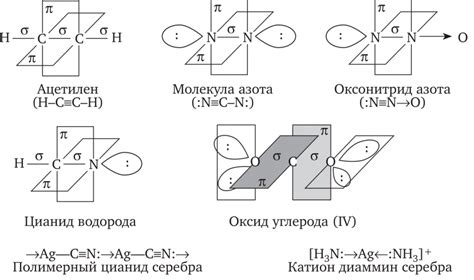
Электронные пары представляют собой области пространства, где могут находиться электроны. Валентная электронная пара находится внутри атома и не участвует в химической связи, в то время как связывающая электронная пара образует связь между двумя атомами. Свободная электронная пара находится на атоме и не связана с другими атомами.
Электронные пары определяют геометрию молекул и их свойства. Они могут создавать электронные облака вокруг атомов, формируя химические связи, или существовать в одиночестве, обеспечивая атомам электронную плотность.
Распределение электронных пар влияет на положение атомов в пространстве, что в свою очередь определяет форму молекулы и ее свойства. Например, электронные пары могут создавать углы между атомами, образуя линейные, треугольные, пирамидальные или плоские структуры.
Электронные пары также влияют на химическую реакцию. Наличие свободной электронной пары на атоме делает его более реакционноспособным, так как эта пара может образовать новую связь с другими атомами. Кроме того, связывающие электронные пары могут быть перераспределены во время химической реакции, создавая новые связи или разрывая старые.
Методы определения электронных пар

Электронные пары играют ключевую роль в химических соединениях, определяя их свойства и реакционную способность. Существует несколько методов, которые позволяют определить количество электронных пар в составе химического соединения.
1. Метод валентности. Этот метод основан на предположении, что каждый атом в химическом соединении имеет определенную валентность, которая определяется его электронной конфигурацией. Зная валентность каждого атома, можно определить количество электронных пар в составе соединения.
2. Спектроскопия. Использование спектроскопических методов позволяет наблюдать электронные переходы в химических соединениях. Этот метод особенно полезен для определения электронных пар в молекулах, так как он позволяет наблюдать электронные переходы между различными областями энергетического спектра.
3. Кристаллография. Кристаллография является мощным методом для определения структуры химических соединений. Она позволяет определить положение атомов в соединении и, следовательно, определить количество электронных пар в каждом атоме.
4. Квантовая химия. Методы квантовой химии позволяют рассчитать распределение электронных пар в химических соединениях с высокой точностью. Они учитывают взаимодействие электронов с атомными ядрами и другими электронами, что позволяет определить количество электронных пар в каждом атоме и связей.
- Метод валентности
- Спектроскопия
- Кристаллография
- Квантовая химия
В зависимости от цели и объекта исследования, каждый из этих методов может быть наиболее подходящим для определения электронных пар в химическом соединении. Комбинирование различных методов позволяет получить более полную и точную информацию о распределении электронных пар в химических соединениях.
Электронные пары и связи в молекулах
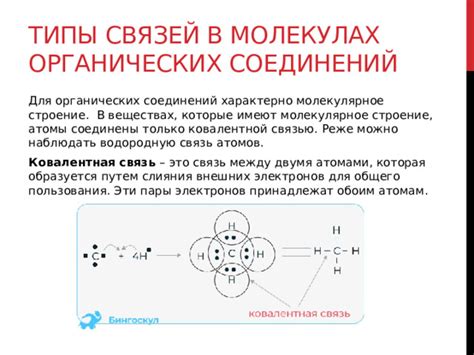
Молекулы химических соединений состоят из атомов, которые образуют связи между собой. Эти связи обусловлены наличием электронных пар, которые участвуют в формировании химических связей.
Электронные пары - это пары электронов, находящиеся внутри атома или между атомами. Они могут быть связанными (объединенными в химическую связь) или непарными (свободными) электронами.
Связи между атомами в молекуле образуются при обмене электронами между атомами. При этом один атом становится донором электронной пары, а другой - акцептором этой пары. У обоих атомов формируется положительный или отрицательный заряд в зависимости от электроотрицательности атомов.
Электронные пары могут быть участвовать в разных типах связей, таких как ковалентная связь, ионная связь или металлическая связь. Ковалентная связь образуется при обмене электронами между неметаллическими атомами, ионная связь - при обмене электронами между металлическим и неметаллическим атомами, а металлическая связь - между атомами одного и того же металла.
Связи, образованные электронными парами, обладают свойствами прочности, длины и полярности. Прочность связи зависит от количества и энергии электронных пар, участвующих в связи. Длина связи определяется расстоянием между атомами, между которыми образуется связь. Полярность связи характеризует разность электроотрицательностей атомов, образующих связь.
Изучение электронных пар и связей в молекулах имеет большое значение для понимания структуры и свойств химических соединений. Это позволяет предсказывать и объяснять химические реакции, свойства соединений и их поведение в различных условиях.
Воздействие электронных пар на свойства соединений
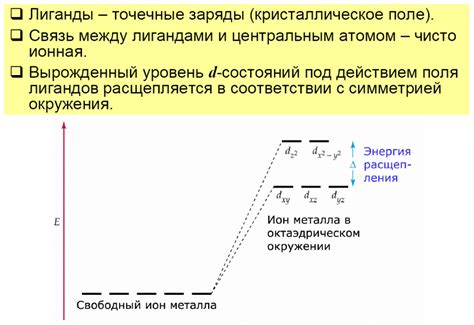
Электронные пары играют важную роль в определении свойств химических соединений. Они влияют на электронную структуру и межатомные взаимодействия, и, следовательно, оказывают влияние на химическую активность и физические свойства соединения.
Электронные пары могут образовывать химические связи между атомами, что приводит к образованию различных структур и форм соединения. Например, образование двух электронных пар между двумя атомами кислорода приводит к образованию двойной связи между ними. Это делает соединение более устойчивым и изменяет его химические свойства.
Электронные пары также могут влиять на полюсность соединений. Некоторые электронные пары могут быть более плотно связаны с одним атомом, что делает его негативно заряженным, в то время как другой атом становится положительно заряженным. Это создает дипольный момент и влияет на растворимость и межмолекулярные силы вещества.
Кроме того, электронные пары могут участвовать в химических реакциях, переходя из одного атома на другой. Это может привести к образованию новых химических связей или разрыву существующих. Например, в реакции между кислородом и водородом, электронная пара кислорода переходит на атом водорода, образуя химическую связь и образуя молекулу воды.
Таким образом, понимание воздействия электронных пар на свойства соединений является важным для понимания и прогнозирования их химического поведения и использования в различных областях, включая фармацевтику, катализ и материаловедение.
Применение электронных пар в химическом синтезе
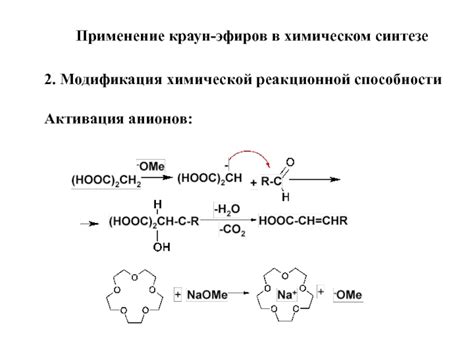
Электронные пары играют важную роль в химическом синтезе, позволяя образование и разрывание химических связей. Использование электронных пар позволяет проводить множество реакций и создавать новые соединения.
Одним из наиболее распространенных применений электронных пар является образование координационных соединений. В таких соединениях электронные пары одного атома образуют связь с другим атомом или ионом. Примером такого соединения может служить комплексный ион, в котором металл образует связь с некоторым лигандом.
Электронные пары также могут быть использованы для проведения реакций замещения, при которых одна группа замещается другой. В этом случае электронные пары атомов участвуют в образовании новых связей, а старые связи разрываются.
Кроме того, электронные пары могут быть использованы для проведения реакций аддиции, при которых два разных молекулярных фрагмента объединяются в одно соединение. В этом случае электронные пары участвуют в образовании новых связей.
Важно отметить, что использование электронных пар в химическом синтезе требует знания электронной структуры соединений и механизмов реакций. Также необходимо учитывать электрофильность и нуклеофильность различных атомов и ионов, чтобы определить, какие электронные пары будут участвовать в реакции.
В результате использования электронных пар в химическом синтезе можно получить разнообразные соединения с различными свойствами. Это позволяет разрабатывать новые материалы, лекарственные препараты и другие важные продукты.