Химия – увлекательная наука, которая исследует строение вещества, его свойства и превращения. Один из важных понятий в химии – объем. Он определяет, сколько места занимает вещество. Научиться находить объем в химии очень важно, так как этот параметр часто используется в различных расчетах и экспериментах.
Самый простой способ найти объем – измерить его с помощью приборов, таких как колба с мерной шкалой или цилиндрическая пробирка. Для этого необходимо заполнить сосуд веществом и считать, до какого уровня оно поднялось по шкале. Однако иногда узнать объем таким способом невозможно или нежелательно.
В этом случае можно использовать математические формулы для нахождения объема вещества. Например, если известна плотность вещества и его масса, то объем можно найти по формуле: объем = масса / плотность. Плотность – это мера компактности вещества, она показывает, сколько массы содержится в единице объема.
Объем вещества также можно найти, зная его размеры. Например, для прямоугольного параллелепипеда объем вычисляется по формуле: объем = длина х ширина х высота. Эту формулу можно применять, если известны все три измерения объекта. При помощи аналогичных формул можно найти объем шара, цилиндра и других геометрических фигур.
В этой статье мы подробно рассмотрим различные способы нахождения объема в химии и приведем примеры для лучшего понимания. Узнавая, как найти объем вещества, вы освоите важные навыки и наберетесь уверенности в своих знаниях химии.
Объем в химии: основные понятия и определения
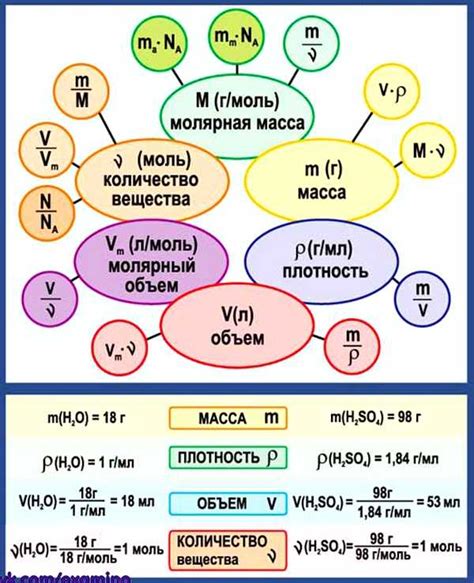
Объем измеряется в кубических единицах, таких как миллилитры (мл), литры (л) или кубические сантиметры (см3). Он может быть измерен с помощью градуированной колбы, цилиндра или других специальных сосудов.
Для определения объема различных тел существуют разные методы. Например, объем жидкостей может быть измерен путем погружения их в специальные сосуды, а объем твердых тел - путем измерения их геометрических размеров и применения соответствующих формул.
В химии также существуют понятия абсолютного и относительного объема. Абсолютный объем относится к именно измеренному объему вещества, в то время как относительный объем представляет собой отношение объема одного вещества к объему другого. Он позволяет сравнивать объемы разных веществ, учитывая их плотность.
Знание и понимание основных понятий и определений, связанных с объемом, являются необходимыми для успешного изучения и практического применения химии. Они помогут вам проводить эксперименты, выполнять расчеты и строить связи между различными веществами.
Что такое объем и зачем он нужен в химии?

В химии объем важен для решения различных задач. Например, при определении концентрации раствора нужно знать объем растворителя и объем раствора для точного определения количества растворенного вещества. Также объем влияет на реакционные условия: при проведении химических реакций важно контролировать объем реакционной смеси для достижения оптимальных результатов.
Измерение объема может проводиться с помощью различных приборов, таких как мерные цилиндры, пипетки, шприцы и др. Точность измерения объема зависит от точности и калибровки используемого прибора. При необходимости объем может быть вычислен с использованием формулы, если известны другие характеристики вещества, такие как масса и плотность.
В общем, изучение объема и его применение в химии позволяют проводить точные измерения и расчеты, необходимые для понимания и управления химическими процессами и взаимодействием веществ.
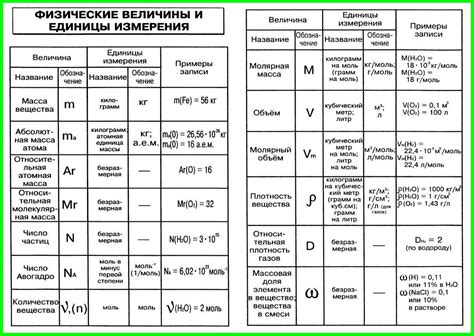
Методы измерения объема в химии
Градуированная пробирка: Градуированная пробирка - это прозрачная стеклянная трубка с подкрашенной шкалой, которая позволяет измерять объем жидкости с высокой точностью. Чтение объема производится путем измерения уровня жидкости на шкале пробирки.
Мерная колба: Мерная колба - это специальная стеклянная посуда с коническим дном и градуированной шкалой. Она используется для приготовления точного объема раствора. Объем измеряется путем чтения уровня жидкости на шкале колбы.
Шприц: Шприц - это металлический или пластиковый цилиндр с поршнем, который позволяет точно измерять и переливать жидкость. Шприцы обычно имеют градуированную шкалу на корпусе для чтения объема.
Бюретка: Бюретка - это стеклянная трубка с краном для очень точного измерения объема раствора. Бюретка используется в титровании, при котором точно измеряется объем одного раствора, необходимый для нейтрализации другого раствора.
Пипетка: Пипетка - это стеклянная или пластиковая трубка с узким концом, которая используется для точного измерения малых объемов жидкости. Пипетки могут быть одноразовыми или с повторным использованием.
Использование правильных методов измерения объема позволяет получать точные результаты при проведении химических экспериментов и реакций. При выборе метода измерения необходимо учитывать требования конкретного эксперимента и допустимую погрешность измерений.
Градуированная пробирка: простой и точный способ измерения объема

Преимущества использования градуированной пробирки:
- Простота использования: для измерения объема достаточно наливать жидкость в пробирку до определенного деления на масштабе.
- Точность измерений: градуированная пробирка позволяет измерять объемы с точностью до десятых и сотых долей миллилитра.
- Использование в различных экспериментах: градуированные пробирки часто используются для измерения объемов реагентов при проведении различных химических реакций.
- Удобство хранения: градуированные пробирки обычно имеют малый объем, что упрощает хранение и экономит место на столе или в шкафу.
Как использовать градуированную пробирку:
- Установите градуированную пробирку вертикально на ровной поверхности.
- Придерживайте пробирку за верхнюю часть и осторожно наливайте жидкость до определенного деления на масштабе.
- Остановите процесс наливания, когда нижний конец жидкости совпадет с делением на масштабе.
- Считайте число миллилитров, указываемых масштабом пробирки, и запишите это значение.
Следует помнить, что для получения более точных результатов обычно используют несколько градуированных пробирок с различными масштабами, чтобы избежать ошибок и учеть возможное изменение объема при температурных или давлении изменениях.
Градуированная пробирка - незаменимый инструмент при работе в химической лаборатории, который обеспечивает точные измерения объемов и помогает проводить различные эксперименты с высокой степенью точности и надежности.
Формулы для расчета объема в химии

В химии существуют различные формулы, которые помогают рассчитывать объем различных веществ. Знание этих формул позволяет ученикам 8 класса вычислять объемы при решении задач в химии.
Ниже приведены некоторые распространенные формулы для расчета объема в химии:
- Объем твердого тела можно найти с помощью формулы: V = l × w × h, где l - длина, w - ширина и h - высота.
- Объем прямоугольного параллелепипеда можно найти с помощью формулы: V = a × b × h, где a и b - длина и ширина основания соответственно, а h - высота.
- Объем цилиндра можно найти с помощью формулы: V = πr2h, где r - радиус основания, а h - высота.
- Объем шара можно найти с помощью формулы: V = (4/3)πr3, где r - радиус.
- Объем пирамиды можно найти с помощью формулы: V = (1/3) × b × h, где b - площадь основания, а h - высота.
Зная эти формулы, ученик может легко рассчитать объем различных фигур и веществ в химии. Они особенно полезны при решении задач, которые требуют вычисления объема различных объектов.
Формула объема идеального газа по уравнению состояния

Объем идеального газа можно вычислить, используя уравнение состояния, которое применяется для описания поведения газов. Уравнение состояния идеального газа формулируется следующим образом:
PV = nRT
где:
- P - давление газа (в Паскалях)
- V - объем газа (в литрах)
- n - количество вещества газа (в молях)
- R - универсальная газовая постоянная, которая равна приблизительно 8.314 Дж/(моль·К)
- T - температура газа (в Кельвинах)
Для нахождения объема газа по уравнению состояния нужно следовать нескольким шагам:
- Задать известные величины: давление (P), количество вещества газа (n), универсальную газовую постоянную (R) и температуру (T).
- Подставить известные величины в уравнение состояния PV = nRT и решить его относительно объема (V).
Например, если дано уравнение состояния PV = nRT и известны следующие значения: P = 1 атм, n = 2 моль, R = 0.0821 л·атм/(моль·K) и T = 300 K, то можно вычислить объем газа используя следующие шаги:
- Заменить известные значения в уравнение состояния: (1 атм) * V = (2 моль) * (0.0821 л·атм/(моль·K)) * (300 K).
- Решить уравнение относительно V: V = (2 моль) * (0.0821 л·атм/(моль·K)) * (300 K) / (1 атм) = 49.26 литров.
Таким образом, объем газа будет равен 49.26 литров.
Практические примеры расчета объема в химии

Для понимания и применения основных принципов и формул химических расчетов, необходимо уметь правильно определять объем в химических реакциях. Ниже приведены несколько примеров, которые помогут вам разобраться в этой теме.
Пример 1. Рассчитайте объем пропана (C₃H₈), который необходимо сжечь для выделения 180 граммов углекислого газа (CO₂). Известно, что упрощенное уравнение реакции сгорания пропана выглядит так:
C₃H₈ + 5O₂→ 3CO₂ + 4H₂О
Для решения этой задачи необходимо сначала найти количество вещества углекислого газа, используя его молярную массу. Затем, используя коэффициенты уравнения реакции, найдите количество вещества пропана. И наконец, используя молярную массу пропана, найдите его объем:
Молярная масса CO₂ = 12.01 г/моль + 16.00 г/моль × 2 = 44.01 г/моль
Молярная масса C₃H₈ = 12.01 г/моль × 3 + 1.01 г/моль × 8 = 44.11 г/моль
Количество вещества CO₂ = масса CO₂ / молярная масса CO₂ = 180 г / 44.01 г/моль ≈ 4.09 моль
Количество вещества C₃H₈ = (3/3) × количество вещества CO₂ = (3/3) × 4.09 моль ≈ 4.09 моль
Объем C₃H₈ = количество вещества C₃H₈ × молярный объем (при стандартных условиях) = 4.09 моль × 22.4 л/моль ≈ 91.7 л
Пример 2. Рассчитайте объем азотной кислоты (HNO₃), необходимой для нейтрализации раствора щелочи массой 10 граммов (NaOH). Известно, что упрощенное уравнение реакции нейтрализации выглядит так:
NaOH + HNO₃ → NaNO₃ + H₂О
Для решения этой задачи необходимо сначала найти количество вещества NaOH, используя его молярную массу. Затем, используя коэффициенты уравнения реакции, найдите количество вещества HNO₃. И наконец, используя молярную массу HNO₃, найдите его объем:
Молярная масса NaOH = 22.99 г/моль + 16.00 г/моль + 1.01 г/моль = 39.0 г/моль
Молярная масса HNO₃ = 1.01 г/моль + 14.01 г/моль + 16.00 г/моль × 3 = 63.0 г/моль
Количество вещества NaOH = масса NaOH / молярная масса NaOH = 10 г / 39.0 г/моль ≈ 0.256 моль
Количество вещества HNO₃ = (1/1) × количество вещества NaOH = (1/1) × 0.256 моль ≈ 0.256 моль
Объем HNO₃ = количество вещества HNO₃ × молярный объем (при стандартных условиях) = 0.256 моль × 22.4 л/моль ≈ 5.74 л
Это были примеры расчета объема в химии. Решение подобных задач поможет вам лучше понять и применять различные принципы и формулы химических расчетов.