Катализатор – это вещество, которое способствует более быстрому протеканию химической реакции без изменения своего состава. Катализаторы широко используются в промышленности и в лабораторных условиях для ускорения реакций и экономии энергии.
Катализаторы могут влиять на химическую реакцию, изменяя активационную энергию, направление протекания реакции или скорость ее протекания. Они действуют путем ускорения стадий реакции, обеспечивая образование промежуточных комплексов или уменьшая энергию активации.
Катализаторы могут быть гетерогенными, когда они находятся в различной фазе с реагентами, или гомогенными, когда они находятся в одной фазе с реагентами. Гетерогенные катализаторы широко распространены в промышленных процессах и используются для синтеза различных материалов, включая пластик, фармацевтические препараты, удобрения и сжигание топлива.
Катализаторы могут быть использованы для улучшения выбора продуктов реакции, повышения процента полезных продуктов и снижения образования побочных продуктов. Они также могут увеличить стабильность реакции и облегчить процесс разделения продуктов. Важно отметить, что катализаторы могут быть специфичными для определенных реакций, что означает, что они могут способствовать только определенным типам химических превращений.
Как катализатор влияет на химическую реакцию?

Катализаторы действуют путем образования промежуточных соединений с реагирующими веществами, что снижает энергию активации. Благодаря этому, реакция может протекать быстрее и при более низкой температуре, что является важным преимуществом в промышленности.
Кроме того, использование катализаторов позволяет существенно снизить количество побочных продуктов и отходов в реакции, что делает ее более эффективной и экологически безопасной.
Катализаторы могут быть гетерогенными, когда они находятся в разнофазной системе с реагирующими веществами, или гомогенными, когда они полностью смешиваются с реагентами в одной фазе. Их эффективность зависит от таких факторов, как вид катализатора, его концентрация, температура и давление реакции.
В биологических системах также присутствуют ферменты – белковые катализаторы, которые обладают высокой специфичностью и могут катализировать реакции при низких температурах и естественном pH.
Таким образом, катализаторы играют важную роль в химических процессах, способствуя повышению скорости реакции, снижению энергии активации и улучшению эффективности химических процессов в промышленности и в природе.
Ускорение химической реакции посредством катализатора

Катализаторы могут быть разных типов: гомогенные, гетерогенные и ферментативные. Гомогенные катализаторы находятся в одной фазе с реагентами, гетерогенные – в отдельной фазе, а ферментативные – это белки, которые проводят биологическую катализ реакций в организмах.
Как именно катализаторы ускоряют реакцию?
Основной механизм действия катализаторов заключается в изменении пути протекания реакции. Они могут предоставлять альтернативные реакционные пути с более низкой энергией активации. Это позволяет молекулам реагирующих веществ сталкиваться чаще и с большей энергией, что повышает скорость реакции.
Кроме того, катализаторы могут повышать концентрацию молекул реагирующих веществ на поверхности своих частиц, создавая таким образом более благоприятные условия для взаимодействия.
Преимущества использования катализатора:
1. Повышение скорости реакции – катализаторы позволяют существенно ускорить протекание химических процессов.
2. Снижение затрат – благодаря катализаторам можно использовать более экономичные реакционные условия, что позволяет сократить затраты на энергию или реактивы.
3. Уменьшение побочных продуктов – катализаторы могут способствовать образованию только необходимых продуктов реакции и блокировать побочные реакции.
Заключение
Катализаторы играют важную роль в химических реакциях, позволяя ускорить процессы и снизить затраты. Использование катализаторов имеет большое значение в промышленности, медицине и других областях, где важно эффективно проводить химические превращения.
Снижение температуры реакции благодаря действию катализатора
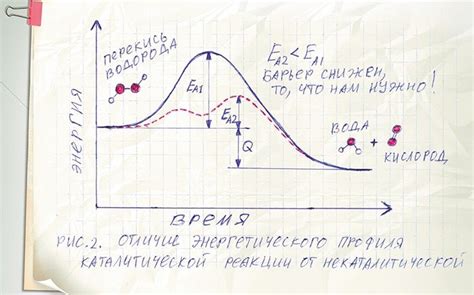
Это происходит благодаря специфическому действию катализатора на промежуточные стадии реакции. Катализаторы вовлекаются в химические реакции, образуя временные комплексы с реагентами и облегчая переход от одного состояния к другому.
В результате, энергия активации реакции с катализатором значительно снижается, что позволяет молекулам реагентов проходить через потенциальные барьеры и образовывать продукты при более низких температурах. Это позволяет снизить энергетические затраты на проведение химической реакции и обеспечить экономическую эффективность процесса.
Снижение температуры реакции благодаря действию катализатора имеет ряд практических применений. Например, в промышленности использование катализаторов позволяет проводить процессы при более низких температурах, что снижает затраты на обогрев и повышает безопасность производственных условий.
Наиболее известными примерами снижения температуры реакции благодаря действию катализаторов являются процессы габаритного превращения и депревращения, которые используются, например, в нефтеперерабатывающей промышленности. При помощи катализаторов такие реакции могут протекать при более низких температурах, что позволяет снизить затраты и повысить эффективность процессов.
Изменение механизма химической реакции под влиянием катализатора

Механизм реакции – последовательность элементарных шагов, через которые проходит реакция. Под влиянием катализатора элементарные шаги могут меняться, появляться новые или исчезать старые. Это приводит к изменению суммарного процесса реакции и увеличению скорости ее протекания.
Катализатор может обладать разными эффектами на механизм реакции:
| Эффект | Описание |
|---|---|
| Активация реагентов | Катализатор может вмешаться в реагенты, инициируя сложные преобразования молекул и ускоряя скорость реакции. |
| Образование промежуточных соединений | Катализат может образовывать промежуточные соединения с реагентами или продуктами, которые способствуют протеканию реакции. |
| Предоставление новых путей реакции | Катализатор может быть активным центром, который предоставляет альтернативные пути превращения реагентов в продукты. |
| Снижение энергии активации | Катализатор может снизить энергию активации химической реакции, уменьшая энергетический барьер и повышая вероятность проступления реакции. |
Благодаря изменениям в механизме реакции, катализаторы позволяют происходить химическим реакциям при более низких температурах и в условиях, при которых они обычно не могут протекать. Поэтому катализаторы широко применяются в промышленности для увеличения эффективности процессов и снижения затрат на энергию и сырье.



