Состояние вещества - это его физическое состояние, которое определяется взаимодействием молекул и атомов, из которых оно состоит. Вещество может находиться в трех основных состояниях: твердом, жидком или газообразном. Изменение состояния вещества возможно при изменении температуры и давления.
Вещества в твердом состоянии имеют определенную форму и объем, а их молекулы находятся настолько близко друг к другу, что они не могут свободно двигаться. Чтобы изменить твердое состояние вещества, необходимо изменить его температуру. При повышении температуры твердое вещество начинает плавиться и переходит в жидкое состояние.
Жидкие вещества, в отличие от твердых, не имеют определенной формы, но они имеют определенный объем. В жидком состоянии молекулы вещества могут свободно перемещаться, но они все еще находятся достаточно близко друг к другу. Чтобы изменить жидкое состояние вещества, можно изменить температуру. При повышении температуры жидкое вещество начинает кипеть и переходит в газообразное состояние.
Газообразные вещества не имеют определенной формы и объема. Молекулы газообразного вещества находятся настолько далеко друг от друга, что они могут свободно перемещаться и заполнять все доступное пространство. Чтобы изменить газообразное состояние вещества, можно изменять температуру и давление. При снижении температуры или повышении давления газообразное вещество может конденсироваться и переходить в жидкое или твердое состояние соответственно.
Вода - от жидкого к твердому

Для того, чтобы вода стала твердой, необходимо снизить ее температуру до значения 0°C (при нормальных условиях давления). При этой температуре между молекулами воды начинают образовываться водородные связи, что приводит к образованию упорядоченной структуры и образованию ледяных кристаллов.
В твердом состоянии, вода имеет определенную форму и объем. Кристаллическая структура льда образует регулярные шестиугольные плоскости, которые отличают лед от других твердых веществ.
Переход из жидкого состояния в твердое и наоборот, является физическим процессом и обратимым. Таким образом, при повышении температуры лед начинает плавиться и превращаться обратно в жидкую воду.
Изменение состояния воды от жидкого к твердому и обратно играет важную роль в природе. Оно является одной из основных причин возникновения ледников и снега, осуществляет регуляцию климата и позволяет обеспечить выживание организмов в холодных регионах.
Кристаллизация воды

Когда температура воды достигает определенного значения, обычно ниже 0°С, начинается процесс кристаллизации. Вода медленно преображается в лед, образуя регулярные молекулярные структуры. Каждая молекула воды становится частью кристалла, принимая строго определенное положение в кристаллической решетке.
Кристаллы льда обладают характерными свойствами, такими как прозрачность, твердость и определенная геометрическая форма. Кристаллические молекулярные структуры содержат подшаблоны, называемые островками роста, вокруг которых образуются новые молекулярные слои. Этот процесс продолжается до тех пор, пока вода полностью не замерзнет.
Кристаллизация воды не только происходит в природе, но и может быть произведена искусственно. Этот процесс используется в промышленности для получения чистой воды, в производстве пищевых продуктов для придания им определенной текстуры и хрустящести, а также в процессах замораживания и консервирования.
Кристаллизация воды также имеет значение в биологии. Например, при замораживании воды внутри клеток организмов могут образовываться льдины, которые могут повредить структуры клеток. Ряд живых организмов разработали специальные механизмы для защиты от кристаллизации воды в их внутренних структурах, например, производят антифризные соединения, которые предотвращают замерзание.
Влияние температуры на состояние воды

При комнатной температуре, установившейся в районе 20°C, вода находится в жидком состоянии. Однако снижение температуры до 0°C приводит к образованию льда. В этом состоянии молекулы воды упорядочены в регулярную кристаллическую решетку. Обратный процесс - плавление льда - происходит при повышении температуры до 0°C. Вода возвращается в жидкое состояние, а молекулы становятся более подвижными.
Дальнейшее повышение температуры приводит к кипению воды. При температуре 100°C в море становится возможным появление пузырьков пара. Это происходит из-за изменений в структуре жидкости и перехода части молекул в паровую фазу. При этом температурном значении вода начинает превращаться в водяной пар. Обратный процесс - конденсация пара - происходит при охлаждении до 100°C. Вода возвращается в жидкое состояние, а паровые молекулы сливаются между собой.
Таким образом, температура играет решающую роль в изменении состояния воды. Она может привести к появлению льда, переходу от жидкого состояния к газообразному и обратно. Изучение этих процессов позволяет не только понять физическую природу воды, но и использовать ее в различных отраслях науки и производства.
Изменение состояния воды под действием давления

Под действием давления вода может перейти из одного состояния в другое. Обычно, при атмосферном давлении, вода находится в жидком состоянии. Однако, изменение давления может привести к изменению ее физического состояния.
При пониженном давлении, вода может перейти в газообразное состояние без предварительного перехода в жидкое состояние, благодаря процессу испарения. Например, при пониженном давлении на горных вершинах, вода может кипеть уже при низкой температуре.
С другой стороны, при повышенном давлении вода может перейти в твердое состояние, образуя лед или снег. Повышенное давление может сжать воду настолько, что межмолекулярные взаимодействия настолько усилятся, что молекулы воды будут находиться в более упорядоченном состоянии.
Таким образом, вода может изменять свое состояние под воздействием давления - переходя из жидкого в газообразное состояние при пониженном давлении и из жидкого в твердое состояние при повышенном давлении.
Парообразование и конденсация воды

Конденсация – обратный процесс парообразования, при котором пар превращается обратно в жидкость. Снижение температуры воздуха, контакт с холодными поверхностями или повышение давления приводят к сжижению водяного пара и образованию капель жидкости. При этом выделяется теплота конденсации – теплота, передаваемая в окружающую среду при переходе единицы вещества из газообразного состояния в жидкое.
Изменение состояния вещества через фазовые переходы
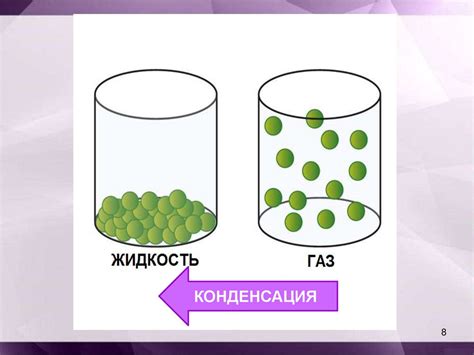
Существуют три основных фазовых перехода: плавления, кипения и конденсации.
Плавление – это фазовый переход из твердого состояния в жидкое при повышении температуры. В данном случае, частицы вещества приобретают достаточно энергии для того, чтобы покинуть упорядоченное положение и начать двигаться свободно. В результате, межчастичные связи ослабевают и вещество становится жидким. Примером плавления может быть плавление льда при повышении температуры выше 0°C.
Кипение – это фазовый переход из жидкого состояния в газообразное при повышении температуры. В жидкости частично существует межчастичные связи, которые не позволяют ей расширяться до газообразного состояния. Однако, при нагревании жидкость получает столько энергии, что межчастичные связи полностью слабеют и вещество начинает переходить в газообразное состояние. Примером кипения может быть кипение воды при достижении температуры 100°C.
Конденсация – это фазовый переход из газообразного состояния в жидкое при понижении температуры. При охлаждении газа, частицы вещества теряют энергию, и межчастичные связи начинают проявляться. В результате, вещество начинает снова образовывать упорядоченную структуру и становится жидким. Примером конденсации может быть конденсация пара на холодной поверхности.
Фазовые переходы имеют много применений в нашей повседневной жизни. Например, плавление и кипение веществ используются в приготовлении пищи, обогревании, производстве электроэнергии и т.д. Изучение фазовых переходов веществ помогает нам понять много интересных явлений и применить их в различных областях науки и техники.
Фазовый переход вещества без изменения температуры или давления
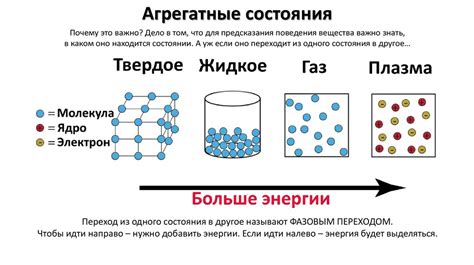
Одним из примеров фазового перехода без изменения температуры или давления является сублимация. Сублимация – это процесс прямого перехода вещества из твердого состояния в газообразное без промежуточной жидкой фазы. Такой переход наблюдается у некоторых веществ, например, льда при низкой влажности воздуха.
Еще одним примером является обратный процесс – конденсация. Конденсация – это процесс прямого перехода вещества из газообразного состояния в твердое или жидкое без промежуточной жидкой фазы. Примером конденсации может служить образование росы или иней на поверхности предметов при охлаждении влажного воздуха.
Фазовые переходы без изменения температуры или давления имеют важное значение в различных сферах научных и технических исследований. Изучение таких процессов помогает понять особенности поведения вещества и применять их в разработке новых материалов, технологиях и производственных процессах.
Примеры изменения состояния вещества в природе и повседневной жизни

| Пример | Изменение состояния |
|---|---|
| Растение | Вода, поглощенная корнями растения, превращается в водяные пары в результате процесса испарения. Также вода может замерзать или превращаться в лед при низких температурах. |
| Варение яиц | Сырое яйцо, помещенное в кипяток или горячую воду, изменяет свое состояние на твердое благодаря процессу свертывания белка. |
| Кипячение воды | При нагревании вода начинает кипеть и превращается водяной пар, который можно наблюдать в виде облаков или пара из чайника. |
| Конденсация пара | Когда горячий пар встречает холодную поверхность, он конденсируется и превращается в капли воды. Например, на зеркале после душа образуется конденсат. |
| Замерзание воды | При понижении температуры вода замерзает и превращается в лед. Это можно наблюдать, когда на улице температура опускается ниже 0°C. |
Это лишь некоторые примеры изменения состояния вещества, которые происходят в природе и в нашей повседневной жизни. Умение распознавать и понимать эти процессы помогает нам лучше понять мир вокруг нас и использовать их в практических целях.