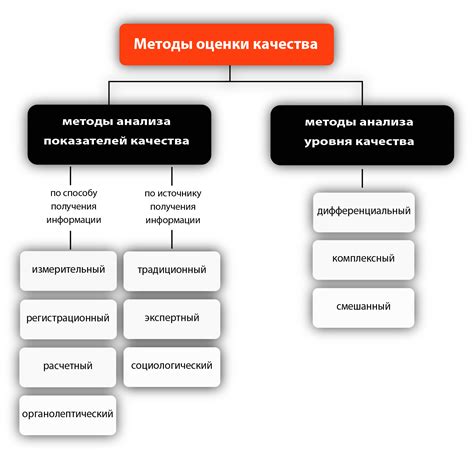
Оксиды - это важный класс химических соединений, которые содержат кислород и одно или несколько других химических элементов. Они играют ключевую роль во многих химических реакциях и имеют широкий спектр применений, начиная от промышленных процессов до биологических систем. Однако, для правильной идентификации оксидов и определения их вида требуется использование специальных методов анализа.
Определение вида оксида в химии представляет собой процесс определения химической формулы и структуры соединения. Это очень важно для понимания его свойств, реакционной активности и возможного использования. Существует несколько методов, которые позволяют точно определить вещественный состав оксидов и классифицировать их по элементному составу и химическим свойствам.
Одним из основных методов для определения вида оксидов является анализ химической формулы. В ходе данного анализа определяется количество и тип атомов каждого элемента, присутствующих в оксиде. Это позволяет установить формулу соединения. Кроме того, использование спектроскопических методов (например, инфракрасной или рентгенофлюоресцентной спектроскопии) позволяет определить структуру и свойства молекулы оксида. Эти методы основаны на измерении оптических и/или электронных свойств вещества, а также на анализе спектральных данных.
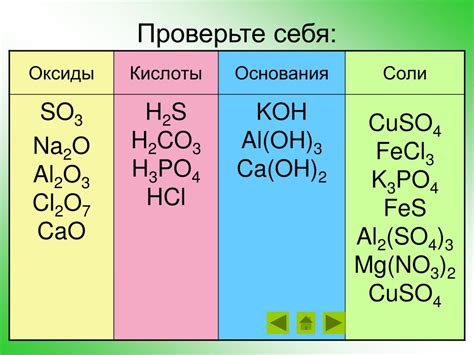
Примерами оксидов являются двуокись углерода (CO2) и оксид железа (Fe2O3). Двуокись углерода состоит из одного атома углерода и двух атомов кислорода, поэтому ее химическая формула - CO2. Это безцветный газ, который широко применяется как удобрение, растворитель и вещество для газирования напитков. Оксид железа, с другой стороны, состоит из двух атомов железа и трех атомов кислорода, образуя формулу Fe2O3. Он обладает красной окраской и широко используется в производстве красок и пигментов.
Определение вида оксида в химии

Существует несколько методов определения вида оксида:
- Метод по химическим свойствам: Оксиды различных элементов нередко проявляют сходные химические свойства. Например, некоторые оксиды способны реагировать с водой, образуя кислоты или щелочи. Поэтому, проведение химических реакций с оксидами может помочь в определении их типа.
- Метод по физическим свойствам: Оксиды отличаются по своим физическим свойствам, таким как цвет, плотность, температура плавления и кипения. Измерение и анализ этих физических свойств может помочь в идентификации вида оксида.
- Метод спектрального анализа: Спектральный анализ, такой как инфракрасная спектроскопия и ультрафиолетовая видимая спектроскопия, позволяет идентифицировать элементы в оксиде на основе их уникального спектра поглощения или излучения.
Примеры различных видов оксидов в химии:
- Оксид азота (NO2)
- Оксид углерода (CO2)
- Оксид железа (Fe2O3)
- Оксид алюминия (Al2O3)
- Оксид серы (SO2)
Знание типа оксидов имеет важное значение для понимания и изучения различных химических процессов, включая окисление, редукцию и образование кислот и щелочей.
Методы определения
Одним из примеров такого метода определения является реакция оксида с водой. Некоторые оксиды, например оксиды неметаллов, могут реагировать с водой, образуя кислоты. Это позволяет определить вид оксида как оксид неметалла. Например, реакция диоксида серы с водой образует серную кислоту:
SО2 + H2O = H2SO4
Другим методом определения вида оксида является его реакция с щелочью или основанием. Некоторые оксиды могут реагировать с щелочью, образуя соль и воду. Например, реакция оксида кальция с щелочью образует гидроксид кальция:
CaO + 2NaOH = Ca(OH)2 + Na2O
Анализ химических свойств оксида позволяет определить его вид и классифицировать его в соответствии с общепринятыми схемами классификации оксидов.
Но для более точного и точного определения вида оксида может потребоваться использование других методов, таких как спектральный анализ или рентгеноструктурный анализ.
Химический метод определения

Химический метод определения вида оксида основан на реакциях, которые конкретный оксид может провести с определенными реактивами. Этот метод позволяет определить наличие или отсутствие определенных элементов в оксиде и, соответственно, классифицировать его как оксид металла или неметалла.
| Оксид металла | Химический метод определения |
|---|---|
| Оксид железа (III) | Растворение в соляной кислоте с выделением газа хлора |
| Оксид кальция | Растворение в уксусной кислоте с образованием соли кальция |
| Оксид алюминия | Растворение в щелочи с образованием соли алюминия и выделением аммиака |
Химический метод определения вида оксида является одним из основных методов в химии, позволяющим установить основные свойства и состав оксида. Он широко используется при исследовании различных веществ и имеет множество применений в научных и прикладных целях.
Физический метод определения

Суть метода термического разложения заключается в нагревании оксида, в результате чего происходит его распад на элементарные составляющие. При этом осуществляется измерение изменений массы образца и его объема.
Например, при разложении оксида меди II (CuO) на медь (Cu) и кислород (O₂), масса образца уменьшается, а объем кислорода, выделяемого при разложении, можно измерить.
В простых случаях, когда оксид является газообразным, методом определения может служить газовый анализ. После термического разложения оксида можно собрать выделившийся газ в специальную аппаратуру и определить его состав при помощи спектрального анализа или газового анализатора.
Физические методы определения вида оксида позволяют получить точные и надежные результаты, однако они требуют специальной аппаратуры и некоторой подготовки образца. Поэтому, перед проведением физического анализа следует изучить соответствующие методики и возможности оборудования.
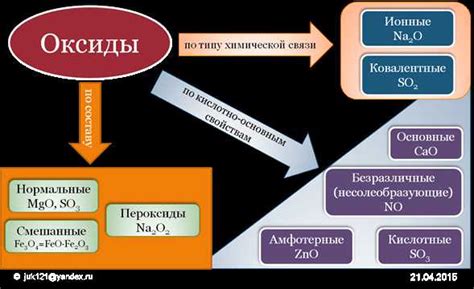
Примеры оксидов
| Оксид | Формула |
|---|---|
| Оксид кислорода (двуокись) | O2 |
| Оксид углерода (угарный газ) | CO2 |
| Оксид серы (диоксид серы) | SO2 |
| Оксид азота (диоксид азота) | NO2 |
| Оксид алюминия | Al2O3 |
| Оксид железа (трехокись железа) | Fe2O3 |
Это лишь небольшой список оксидов, существует множество других соединений, которые также являются оксидами. Оксиды играют ключевую роль во многих химических реакциях и имеют широкий спектр применений в различных областях, включая промышленность, медицину и электронику.
Роль оксидов в химических реакциях
Оксиды распространены как в природных, так и в промышленных процессах. Они широко используются в различных отраслях промышленности, включая металлургию, производство стекла и керамики, а также в процессах окисления и восстановления в химической промышленности.
Оксиды играют важную роль в органической химии, а также в биологических процессах. Некоторые оксиды, такие как диоксид углерода (CO2), являются продуктом выдыхания живых организмов и важны для поддержания уровня кислорода в атмосфере. Однако избыток CO2 в атмосфере является основным фактором, способствующим изменению климата и парниковому эффекту.
В реакциях оксидов происходят различные превращения, включая окисление-восстановление, гидролиз, нейтрализацию и другие. Во время окисления-восстановления оксиды служат источниками или потребителями кислорода. Гидролиз оксидов может привести к образованию кислот или оснований. Кроме того, некоторые оксиды имеют амфотерные свойства и могут действовать как кислоты или основания в зависимости от условий реакции.
Изучение роли и свойств оксидов позволяет понять и контролировать множество химических реакций, что имеет важное значение в различных областях науки и технологии.