Аммиак – важное вещество, широко используемое в различных отраслях промышленности и науки. Однако для его эффективного применения необходимо знать его концентрацию в растворе. Для определения этого параметра существует несколько методов, каждый из которых имеет свои преимущества и ограничения.
Одним из наиболее распространенных методов является весовое определение массы аммиака. Суть метода заключается в том, что известный объем раствора аммиака пропускают через осушитель, чтобы удалить всю влагу, а затем измеряют массу полученного сухого вещества. Таким образом, можно рассчитать концентрацию аммиака в растворе по формуле. Этот метод достаточно прост в использовании и дает точные результаты, однако требует использования специального оборудования и занимает довольно много времени.
Другим известным методом является комплексометрическое титрование. В данном случае анализируются растворы аммиака с помощью реакции его соединения с ионами металла, образуя комплексы. Обычно в данной технике используют хелатообразующие реагенты, например, этилендиаминтетрауксусную кислоту (ЭДТА). Точка эквивалентности определяется при помощи индикатора, и по его показаниям рассчитывается концентрация аммиака. Этот метод отличается достаточно высокой точностью результатов и широким спектром применения, однако требует навыков и опыта для его выполнения.
Обзор методов определения массы аммиака в растворе
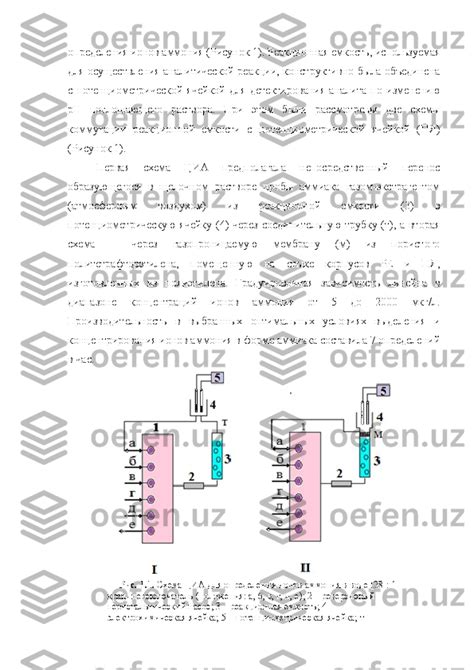
Один из наиболее распространенных методов - титриметрия. Он основан на реакции аммиака с кислотным раствором и измерении объема раствора, необходимого для нейтрализации аммиака. Обычно в качестве индикатора используется фенолфталеин, который меняет цвет при достижении эквивалентной точки титрования. Таким образом, можно рассчитать концентрацию аммиака в растворе.
Второй метод - гравиметрия, основанный на измерении массы аммиака. В этом случае, аммиак приводят в реакцию с избытком кислоты, получая нерастворимую соль. Затем масса полученного осадка измеряется, что позволяет рассчитать концентрацию аммиака.
Еще один метод - спектрофотометрия. Он основан на анализе поглощения света аммиаком в видимой или ультрафиолетовой области спектра. Измерение поглощения позволяет рассчитать концентрацию аммиака в растворе.
Другой метод - электрохимический, основанный на измерении обратной электродной реакции. В данном случае, аммиак окисляется на аноде с последующим измерением тока, который можно использовать для рассчета концентрации аммиака.
| Метод | Принцип | Плюсы | Минусы |
|---|---|---|---|
| Титриметрия | Измерение объема раствора, необходимого для нейтрализации аммиака | - Процедура относительно проста и быстра - Приемлемая точность результата - Возможность автоматизации | - Требует использования кислотного раствора и индикатора |
| Гравиметрия | Измерение массы аммиака | - Высокая точность результата - Не требует сложного оборудования | - Длительный процесс получения и измерения осадка - Возможность ошибки при фильтрации и сушке осадка |
| Спектрофотометрия | Анализ поглощения света аммиаком | - Быстрый и точный результат - Минимальное воздействие на раствор | - Требуется использование специализированного оборудования - Ограничения в видимой или ультрафиолетовой области спектра |
| Электрохимический | Измерение обратной электродной реакции | - Быстрый результат - Относительно низкая стоимость проведения анализа | - Возможность ошибки при подготовке раствора и измерении тока - Воздействие электрода на раствор |
Выбор метода определения массы аммиака в растворе зависит от целей и требований исследования, доступности оборудования и квалификации аналитика.
Фотометрический метод анализа аммиака

Для проведения фотометрического анализа аммиака необходимо использовать специальные реагенты и приборы. Одним из ключевых реагентов в этом методе является нингидрин – органическое соединение, обладающее способностью образовывать с аммиаком стабильные комплексы, которые имеют интенсивное поглощение в ультрафиолетовой области спектра.
Процесс определения массы аммиака начинается с приготовления раствора, содержащего аммиак. Затем к данному раствору добавляется реагент нингидрин, и происходит образование комплекса аммиака с нингидрином. Полученный раствор затем помещается в фотометр – прибор для измерения интенсивности поглощаемого света.
При проведении измерения в фотометре, происходит поглощение света комплексом аммиака с нингидрином. Измеряется интенсивность поглощения света, и на основе этого значения определяется масса аммиака в растворе.
Фотометрический метод обладает рядом преимуществ, таких как относительная простота проведения анализа, высокая точность результатов и возможность автоматизации измерений. Однако этот метод также требует наличия специального оборудования и знания основ измерения поглощения света.
Тем не менее, фотометрический метод анализа аммиака остается незаменимым инструментом для многих лабораторий и исследовательских центров во всем мире, позволяя точно и надежно определить массу аммиака в различных типах растворов.
Электроколориметрический метод измерения аммиака
Основной принцип метода заключается в измерении изменения цвета раствора аммиака под воздействием электродов. При этом используется устройство, способное фиксировать и анализировать электрические сигналы, изменение которых связывается с концентрацией аммиака в растворе.
При проведении измерений применяются специальные электроды, которые вступают в реакцию с аммиаком и образуют комплексы, обладающие различной окраской в зависимости от концентрации аммиака. Эти изменения в цвете раствора позволяют определить массу аммиака в растворе.
Одно из преимуществ электроколориметрического метода заключается в его высокой чувствительности и точности измерений. Также этот метод отличается высокой стабильностью, что позволяет получать повторяемые результаты. Более того, электроколориметрический метод является быстрым и удобным в использовании: для проведения измерений не требуется сложная и длительная подготовка образцов и оборудования.
Однако, следует отметить, что электроколориметрический метод имеет свои ограничения. Например, он чувствителен к наличию других веществ в растворе, которые могут искажать результаты измерений. Также, для проведения измерений требуется специальное оборудование, что может быть ограничивающим фактором в определенных условиях.
В целом, электроколориметрический метод является эффективным инструментом для определения массы аммиака в растворе. Его использование в лабораторных и промышленных условиях позволяет получить точные и достоверные результаты в кратчайшие сроки.
Гравиметрический анализ аммиака

Основными этапами гравиметрического анализа аммиака являются:
- Подготовка и стандартизация осадительного агента. Для осаждения аммиака может использоваться такой осадительный агент, как хлорид бария (BaCl2). Осадительный агент должен быть чистым и содержать определенное количество атомов бария, которые можно точно определить методами химического анализа.
- Подготовка образца. Образец раствора аммиака должен быть предварительно очищен и приготовлен с определенной концентрацией аммиака.
- Осаждение аммиака. Раствор аммиака с осадительным агентом смешивается и ставится на нагревание. При нагревании аммиак осаждается в виде твердого соединения с осадительным агентом.
- Фильтрация и сушка осадка. Полученный осадок смывается с помощью дистиллированной воды и фильтруется для удаления остатков раствора. Затем осадок сушат до постоянной массы, чтобы исключить влияние влаги.
- Взвешивание осадка. Осадок помещается на точную аналитическую весы и взвешивается. Полученное значение массы аммиака с помощью простых расчетов переводят в концентрацию аммиака в исходном растворе.
Гравиметрический анализ аммиака позволяет получить точные результаты при определении его массы в растворе. Однако, данный метод требует длительного времени для проведения и может быть сложен при обработке большого количества образцов. Тем не менее, гравиметрический метод остается важным инструментом в аналитической химии.
Электрохимический способ определения содержания аммиака
Для проведения анализа аммиака с использованием электрохимического способа необходимы специальные электроды, которые обладают высокой селективностью и чувствительностью к аммиаку. Один из таких электродов - ион-селективный электрод, который реагирует только с аммиаком и не реагирует с другими веществами.
Принцип работы электрохимического способа заключается в том, что аммиак, находящийся в растворе, диффундирует к электроду, где происходит окислительно-восстановительная реакция. При этом, создается разность потенциалов между двумя электродами, которая пропорциональна концентрации аммиака в растворе.
Для определения концентрации аммиака электрохимическим способом необходимо измерять изменение потенциала между электродами и провести калибровку методом стандартных растворов аммиака. Результаты измерений обрабатываются при помощи специального аппарата или программы, которые преобразуют сигнал в концентрацию аммиака.
Электрохимический способ определения содержания аммиака широко применяется в различных областях, таких как химическая аналитика, биохимическая диагностика и экологические исследования. Он позволяет проводить анализ быстро и точно, что делает его незаменимым инструментом в лабораторной практике.
Ионно-селективные электроды для анализа аммиака

Основой ионно-селективных электродов является специальная мембрана, проницаемость которой зависит от концентрации ионов аммиака в растворе. Мембрана содержит специфические ионофоры, которые выборочно связываются с ионами аммиака, обеспечивая высокую ионную селективность электрода.
Для проведения измерений с использованием ионно-селективных электродов необходимо поддерживать постоянную концентрацию ионов аммиака в растворе. Этого можно достичь путем использования буферных растворов с определенным pH и контроля температуры раствора. Кроме того, перед началом измерений электрод необходимо калибровать с помощью стандартных растворов с известной концентрацией аммиака.
Преимуществом ионно-селективных электродов является их высокая чувствительность и точность, позволяющая определить массу аммиака даже в низких концентрациях. Благодаря этому методу можно достоверно контролировать концентрацию аммиака в различных областях промышленности, в том числе в процессах переработки нефти, производстве удобрений и водоочистке.
Однако, стоит отметить, что применение ионно-селективных электродов требует специальной подготовки и проверки оборудования. Также, для достижения оптимальных результатов необходимо проводить измерения в условиях с определенными параметрами, такими как температура и pH раствора.