Электроны являются основными носителями электрического заряда и играют важную роль в химических реакциях. Ионы - это атомы, которые приобрели или потеряли один или несколько электронов, что приводит к изменению их электрического заряда. Ионы кальция, алюминия и серы являются репрезентативными примерами ионов, важных для понимания химических свойств этих элементов.
Ион кальция Ca2+ имеет два потерянных электрона по сравнению с нейтральным атомом кальция. Нейтральный атом кальция имеет 20 электронов, расположенных на электронных оболочках. Потеря двух электронов приводит к образованию иона Ca2+ с 18 электронами. Такой ион обладает положительным зарядом, поскольку количество протонов (20) превышает количество электронов (18).
Ион алюминия Al3+ имеет три потерянных электрона по сравнению с нейтральным атомом алюминия. Нейтральный атом алюминия также имеет 13 электронов на электронных оболочках. Потеря трех электронов приводит к образованию иона Al3+ с 10 электронами. Ион алюминия также обладает положительным зарядом, так как протонов (13) больше, чем электронов (10).
Ион серы S2- имеет два приобретенных электрона по сравнению с нейтральным атомом серы. Нейтральный атом серы имеет 16 электронов на электронных оболочках. Приобретение двух электронов приводит к образованию иона S2- с 18 электронами. Ион серы обладает отрицательным зарядом, так как количество электронов (18) превышает количество протонов (16).
Особенности количества электронов в ионах кальция, алюминия и серы

Количество электронов в ионах элементов имеет важное значение для понимания их химических свойств. Рассмотрим особенности количества электронов в ионах кальция, алюминия и серы.
- Ион кальция (Ca2+):
- Ион алюминия (Al3+):
- Ион серы (S2-):
Кальций является щелочноземельным металлом, и его ион Ca2+ образуется путем потери двух электронов из внешней оболочки. Ион кальция имеет 18 электронов: 2 электрона в первом энергетическом уровне, 8 электронов во втором и 8 электронов в третьем. Ион кальция является положительно заряженным, что связано с потерей двух электронов.
Алюминий является третьим элементом 13-й группы периодической системы Д.И. Менделеева и обладает атомным номером 13. Ион алюминия Al3+ образуется путем потери трех электронов из внешней оболочки. Ион алюминия имеет 10 электронов: 2 электрона в первом энергетическом уровне и 8 электронов во втором. Это заряженный положительный ион.
Сера – не металл, является 16-м элементом периодической системы Д.И. Менделеева. Ион серы S2- образуется путем получения двух электронов во внешней оболочке. Ион серы имеет 18 электронов: 2 электрона в первом энергетическом уровне, 8 электронов во втором и 8 электронов в третьем. Ион серы является заряженным отрицательным ионом.
Изучение количества электронов в ионах позволяет понять их взаимодействие с другими элементами и определить их химические свойства. Кальций, алюминий и сера являются важными элементами в химии и имеют широкое применение в различных областях науки и технологии.
Количество электронов в ионе кальция
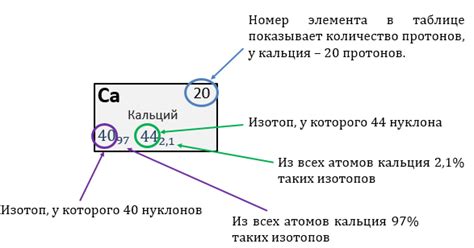
Ион кальция (Ca2+) образуется, когда атом кальция теряет два электрона. Обычный атом кальция имеет 20 электронов, расположенных на трех энергетических уровнях: 2 на первом, 8 на втором и 8 на третьем.
При потере двух электронов ион кальция становится положительно заряженным, так как число протонов в ядре остается неизменным (20), а число электронов уменьшается до 18. Таким образом, в ионе кальция имеется 18 электронов, расположенных на трех энергетических уровнях: 2 на первом, 8 на втором и 8 на третьем.
Количество электронов в ионе алюминия
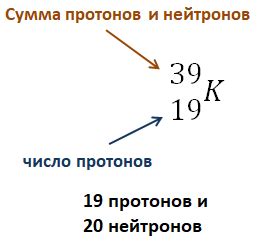
Ион алюминия имеет формулу Al3+, что означает, что в его электронной оболочке на одну электронную оболочку отсутствует 3 электрона по сравнению с нейтральным атомом алюминия.
Изначально, нейтральный атом алюминия содержит 13 электронов, распределенных следующим образом: по 2 электрона на первом и втором энергетических уровнях, и 3 электрона на третьем энергетическом уровне.
Однако, при образовании иона алюминия, последняя электронная оболочка становится неполной, так как она содержит только 2 электрона вместо 8 электронов (как в случае с полностью заполненными оболочками инертных газов). Это обуславливает положительный заряд иона алюминия.
Итак, в ионе алюминия содержится только 10 электронов: по 2 электрона на первом и втором энергетических уровнях, и 6 электронов на третьем энергетическом уровне.
Ион алюминия (Al3+) является одним из важных ионов в химии и имеет широкое применение в различных процессах и реакциях, в том числе в производстве металла алюминия и в производстве различных соединений алюминия.
Количество электронов в ионе серы
Ион серы (S2-) имеет два электрона больше, чем обычный атом серы (S). Обычный атом серы имеет 16 электронов, 8 из которых находятся в внешней оболочке. Когда атом серы принимает два электрона, он становится отрицательно заряженным ионом серы (S2-). Ион серы обладает восемью электронами во внешней оболочке, что обеспечивает его стабильность.
В таблице ниже приведено количество электронов в разных оболочках атома серы:
| Оболочка | Количество электронов |
|---|---|
| К-оболочка | 2 |
| L-оболочка | 8 |
| M-оболочка | 6 |
| Внешняя оболочка | 8 |
Таким образом, ион серы (S2-) имеет общее количество электронов равное 18.
Краткий обзор особенностей количества электронов в ионах кальция, алюминия и серы

В этом разделе мы рассмотрим особенности количества электронов в ионах трех элементов: кальция, алюминия и серы.
Кальций имеет атомный номер 20, что означает, что в нейтральном состоянии у него 20 электронов. При потере двух электронов он становится катионом Ca2+ с 18 электронами. Это делает его стабильным и химически активным элементом, который легко образует ионы.
Алюминий имеет атомный номер 13 и в нейтральном состоянии также имеет 13 электронов. При потере трех электронов становится катионом Al3+ с 10 электронами. Алюминий также обладает высокой химической активностью и образует стабильные ионы.
Сера имеет атомный номер 16, что означает, что в нейтральном состоянии у нее 16 электронов. При приобретении двух электронов она становится анионом S2- с 18 электронами. Сера проявляет выраженную химическую активность и образует различные химические соединения.
Для более наглядного представления приведем информацию в виде таблицы:
| Элемент | Атомный номер | Количество электронов (нейтральный атом) | Количество электронов (ион) | Заряд иона |
|---|---|---|---|---|
| Кальций | 20 | 20 | 18 | Ca2+ |
| Алюминий | 13 | 13 | 10 | Al3+ |
| Сера | 16 | 16 | 18 | S2- |
Таким образом, кальций и алюминий теряют электроны, образуя катионы, в то время как сера приобретает электроны и образует анион. Эти различия в количестве электронов и заряде ионов являются основой для химических свойств и возможности образования химических соединений для каждого из этих элементов.