Произведение растворимости – это величина, отражающая степень растворимости вещества в определенной среде. Она определяет, насколько максимально возможное количество данного вещества может раствориться в данной среде при определенных условиях.
Произведение растворимости является важным показателем при исследовании физико-химических свойств вещества. Оно позволяет оценить его термодинамическую стабильность и способность образовывать растворы.
Существует несколько методов определения произведения растворимости, в зависимости от вещества и условий эксперимента. Один из таких методов – метод измерения концентрации растворенного вещества в зависимости от его растворимости при постепенном изменении условий эксперимента.
Принципы определения произведения растворимости основаны на равновесии между растворенными веществами и основным соединением, их ионными концентрациями и константами равновесия. Для определения произведения растворимости используются математические уравнения и графические методы.
Определение произведения растворимости в химии: основные принципы
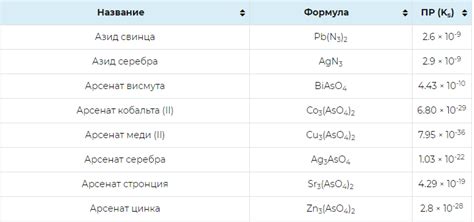
Произведение растворимости, также известное как реакционная способность вещества, являет собой важный показатель, определяющий, насколько вещество способно растворяться в растворе при определенных условиях. Это понятие широко используется в химии и играет важную роль в процессе разработки и анализа химических реакций.
Основным принципом определения произведения растворимости является использование равновесия химической реакции. Равновесие химической реакции достигается, когда скорости прямой и обратной реакций становятся равными. В процессе определения произведения растворимости, учитываются концентрации ионов в растворе на точке равновесия.
Произведение растворимости обычно обозначается как К и рассчитывается путем перемножения концентраций ионов, входящих в химическую реакцию. Если химическая реакция, например, ведет к образованию раствора, то концентрации соответствующих растворенных ионов будут включены в вычисление К.
Пример:
Рассмотрим реакцию растворения соли AgCl в воде:
AgCl (s) → Ag+ (aq) + Cl- (aq)
Произведение растворимости для этой реакции будет вычислено как произведение концентраций Ag+ и Cl- в растворе на точке равновесия.
Важно отметить, что значение произведения растворимости имеет существенное значение для определения, насколько вещество насыщено в растворе при определенных условиях и может оказывать влияние на химические реакции, происходящие в этом растворе. Таким образом, определение произведения растворимости является фундаментальным для понимания и изучения различных аспектов химии.
Важность определения произведения растворимости

Произведение растворимости (Ksp) выражает концентрацию ионов, образующих осадок, и играет важную роль в многих химических процессах и приложениях, включая синтез новых материалов и разработку фармацевтических препаратов.
Произведение растворимости также играет важную роль в окружающей среде, так как может влиять на уровень загрязнения водных ресурсов. Если вещество имеет высокое произведение растворимости, то оно может легко раствориться в воде и проникнуть в грунтовые воды, вызывая экологические проблемы. Определение произведения растворимости помогает оценить возможные риски, связанные с использованием определенного вещества.
Кроме того, знание произведения растворимости имеет практическое применение в лабораторных исследованиях. Оно позволяет определить оптимальные условия растворения вещества, выбрать наиболее эффективные растворители и оптимизировать процесс растворения.
В итоге, определение произведения растворимости является неотъемлемой частью химических исследований и играет важную роль в различных областях, от науки до промышленности и окружающей среды.
Методы определения произведения растворимости

Существует несколько методов определения произведения растворимости, которые широко применяются в лабораторной практике. Некоторые из них включают:
- Метод ионного баланса: Этот метод основан на принципе, что в растворе ионного соединения должен быть равен ионизированным формам ионов указанных в химическом уравнении реакции. Метод ионного баланса позволяет определить концентрацию ионов в растворе и исходя из этого рассчитать произведение растворимости.
- Метод разведения растворов: Этот метод заключается в разбавлении раствора и последующем измерении его концентрации с помощью титрования или инструментального анализа. Затем, с помощью математических расчетов, можно определить произведение растворимости.
- Метод электрохимических измерений: Этот метод основан на использовании электрохимических явлений, таких как снятие потенциала (ЭДС) или потенциостатические измерения. С помощью электрохимических методов можно определить концентрацию ионов и рассчитать произведение растворимости.
К выбору метода определения произведения растворимости необходимо подходить с учетом особенностей ионного соединения и доступности необходимого оборудования и реагентов. Каждый из перечисленных методов имеет свои преимущества и ограничения, поэтому важно выбрать наиболее подходящий метод для конкретной задачи.
Использование одного или нескольких методов определения произведения растворимости позволяет получить точные и надежные данные о степени растворимости ионного соединения, что является важным для многих научных и практических приложений в области химии и материаловедения.