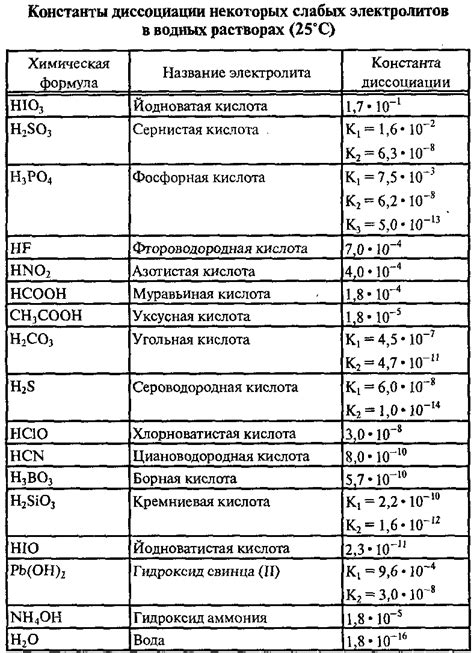
Диссоциация слабого электролита - одно из фундаментальных понятий химии, изучение которого позволяет более глубоко понять процессы, происходящие в различных химических системах. При диссоциации слабого электролита его молекулы разлагаются на ионы в растворе, что сопровождается изменением концентрации этих ионов.
Одним из ключевых показателей, характеризующих процесс диссоциации слабого электролита, является его константа диссоциации. Константа диссоциации отражает степень диссоциации электролита в растворе и зависит от нескольких факторов.
Во-первых, константа диссоциации слабого электролита зависит от его внутренних химических свойств. Некоторые молекулы обладают большей степенью диссоциации, чем другие, вследствие своей структуры и специфических связей. Такие электролиты будут иметь большую константу диссоциации.
Связь константы диссоциации слабого электролита с химическим составом вещества
Влияние химического состава на константу диссоциации слабого электролита проявляется через структуру молекулы и её связи. Слабые электролиты включают в себя многочисленные классы веществ, такие как кислоты, основания и соли. Константа диссоциации каждого из этих классов зависит от силы химических связей, числа и типа атомов в молекуле и других факторов.
Например, для кислот константа диссоциации определяется силой связи водорода между кислородом и водородом, а также электроотрицательностью других атомов в молекуле. Более слабые связи ведут к более большей диссоциации и, следовательно, высокой константе диссоциации.
С другой стороны, для оснований константа диссоциации зависит от способности принять протон, а также структуры основания. Основания с сильными базическими группами будут иметь большую константу диссоциации, поскольку они легче отдают протон и образуют более стабильные ионы.
Таким образом, константа диссоциации слабого электролита тесно связана с химическим составом вещества и его молекулярной структурой. Понимание этой связи позволяет предсказывать и объяснять поведение электролитов в растворах и имеет важное значение в химических исследованиях и промышленности.
Молекулярная структура
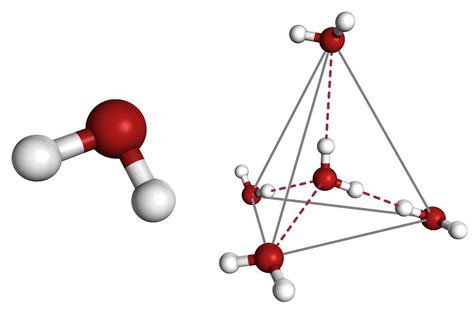
Молекулярная структура слабого электролита играет важную роль в определении его константы диссоциации. Константа диссоциации, обозначаемая как Ka для кислот или Kw для воды, показывает степень диссоциации электролита в растворе.
Молекулярная структура определяет межатомные и межмолекулярные взаимодействия, которые могут блокировать или способствовать диссоциации электролита. Например, если межмолекулярные силы притяжения, такие как водородные связи или диполь-дипольные взаимодействия, сильнее, чем связи внутри молекулы электролита, то диссоциация будет затруднена. Это может привести к низкой константе диссоциации и, следовательно, к слабой кислотности или щелочности электролита в растворе.
С другой стороны, если межмолекулярные силы отталкивания преобладают над привлекательными силами, то молекулы электролита будут легко диссоциировать в ионы. Это приведет к высокой константе диссоциации и, следовательно, к сильной кислотности или щелочности электролита.
Молекулярная структура также может определять размер и форму молекулы электролита, которые, в свою очередь, могут влиять на процесс диссоциации. Большие или несимметричные молекулы могут испытывать более сложные межмолекулярные взаимодействия, что может затруднить процесс диссоциации.
Таким образом, молекулярная структура является одним из ключевых факторов, определяющих константу диссоциации слабого электролита. Понимание молекулярной структуры может помочь предсказать какие электролиты обладают большей диссоциацией в растворе и, следовательно, большей кислотностью или щелочностью.
Величина заряда ионов
Если ионы имеют большой заряд, то они притягивают меньшее количество водных молекул и сильнее связаны с растворителем. Это затрудняет их отделение и увеличивает энергию активации для диссоциации. В результате константа диссоциации оказывается меньше.
С другой стороны, ионы с меньшим зарядом могут притягивать больше водных молекул и слабее связаны с растворителем. Это упрощает их отделение и уменьшает энергию активации для диссоциации. Как следствие, константа диссоциации оказывается больше.
Таким образом, величина заряда ионов непосредственно влияет на степень диссоциации слабого электролита и определяет его константу диссоциации.
| Заряд ионов | Влияние на константу диссоциации |
|---|---|
| Большой заряд | Меньшая константа диссоциации |
| Малый заряд | Большая константа диссоциации |
Растворитель

Растворители могут иметь различные свойства, такие как полярность, вязкость, температура кипения и т.д., которые могут влиять на диссоциацию слабого электролита. Например, полярные растворители, такие как вода, могут способствовать диссоциации электролитов, поскольку они обладают способностью разрывать связи в молекулах электролита и образовывать ионы.
Вязкость растворителя также может оказывать влияние на константу диссоциации. Если растворитель имеет высокую вязкость, частицы слабого электролита могут двигаться медленнее и, следовательно, меньше диссоциировать. Температура кипения растворителя также может играть роль, поскольку повышение температуры может способствовать диссоциации электролита.
Таким образом, выбор растворителя является важным фактором, который может влиять на константу диссоциации слабого электролита. Применение различных растворителей может помочь контролировать процесс диссоциации и, следовательно, изменять константу диссоциации.
Температура

Увеличение температуры также увеличивает энергию столкновения между ионами и реагентами. Это приводит к увеличению скорости обратной реакции диссоциации ионов. Таким образом, при повышении температуры константа диссоциации слабого электролита обычно увеличивается, что означает большую степень диссоциации.
Однако стоит отметить, что зависимость константы диссоциации от температуры не является прямой и может зависеть от типа электролита. Например, некоторые слабые электролиты могут образовывать осадки или подвергаться химической реакции при повышенных температурах, что может снижать их диссоциацию.
Давление
При повышении давления на газовую фазу слабого электролита, молекулы будут сжиматься более плотно, что может приводить к увеличению диссоциации. Однако, если речь идет о растворе, повышение давления может вызывать увеличение количества различных взаимодействий, таких как гидратация и сольватация, что может в конечном итоге снизить диссоциацию электролита.
Присутствие давления также может влиять на равновесие химической реакции, включающей диссоциацию слабого электролита. Если в системе имеется газ или пар, изменение давления может изменить равновесие реакции и, следовательно, константу диссоциации.
Таким образом, давление является важным параметром, который следует учитывать при изучении константы диссоциации слабого электролита. Величина давления может оказывать как положительное, так и отрицательное влияние на диссоциацию, в зависимости от условий системы.
Ионосили

Ионы - это атомы или группы атомов, которые имеют положительный или отрицательный электрический заряд. Они образуются в результате перехода электрона или нескольких электронов от одного атома к другому.
Ионосили в растворах электролитов проявляют свои свойства благодаря своим зарядам. Они участвуют в различных химических реакциях, образуют соединения с другими ионами или молекулами, и именно эта реакционная способность определяет свойства электролита и его константу диссоциации.
Ионосильное диссоциированное состояние слабого электролита позволяет раствору проводить электрический ток и проявлять свойства электролитов, такие как проводимость, коррозия или электролиз. Константа диссоциации слабого электролита зависит от различных факторов, таких как температура, концентрация, растворитель, свойства растворителя и др.
Ионосили разного знака влияют на физические и химические свойства раствора и могут взаимодействовать между собой, образуя новые соединения или выпадая в осадок.



