Атом - это основная строительная единица вещества. Он состоит из ядра, в котором находятся протоны и нейтроны, и облака электронов, которое окружает ядро. Электроны имеют отрицательный заряд и находятся в постоянном движении вокруг ядра, создавая электронную структуру.
Электроны в атоме организованы в энергетические уровни или оболочки. Каждая оболочка может содержать определенное количество электронов. Первая оболочка может содержать до двух электронов, вторая - до восьми, а третья - до восемнадцати. Это называется принципом насыщения оболочек электронами.
Как правило, электроны находятся на самых низких доступных энергетических уровнях. Это называется принципом энергетического минимума. Электроны заполняют оболочки начиная с наименьшей энергии и движутся к оболочкам более высокой энергии по мере нехватки места на предыдущих оболочках.
Однако, существуют исключения:
- Оболочка d: В некоторых случаях, электроны из оболочки s могут переходить на более высокий энергетический уровень - оболочку d. Это приводит к появлению исключений в порядке заполнения электронами.
- Оболочка f: Электроны могут переходить на еще более высокий энергетический уровень - оболочку f. Аналогично, это приводит к исключениям в порядке заполнения оболочек электронами.
В результате такой организации электронов, атомы разных элементов имеют различное количество электронов в оболочках, что определяет их химические свойства. Изучение электронной структуры атома помогает понять многое о веществе и его способности взаимодействовать с другими элементами.
Электроны в атоме: основные свойства и характеристики
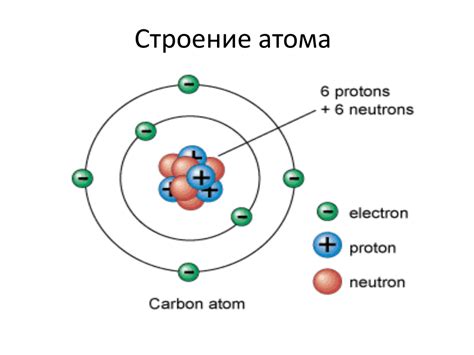
Основные свойства электронов:
- Масса: Масса электрона составляет 9.10938356 × 10^-31 кг. Относительно земной массы, масса электрона очень мала.
- Заряд: Электрон обладает отрицательным зарядом, равным 1.602176634 × 10^-19 Кл.
- Местоположение: Электроны находятся вокруг ядра атома и движутся по разным орбитам, которые называются энергетическими уровнями или электронными оболочками.
- Энергия: Электроны существуют на разных энергетических уровнях, которые определяют их энергию. Чем ближе энергетический уровень к ядру, тем ниже энергия электрона.
- Спин: Электроны имеют собственный магнитный момент, называемый спином, который может быть направлен вверх или вниз.
- Квантовые числа: Каждый электрон характеризуется набором квантовых чисел, которые определяют его энергию, орбитальное движение и магнитный момент.
Понимание электронной структуры атома и его взаимодействия с другими атомами имеет огромное значение в различных областях науки и технологий, от химии и физики до материаловедения и электроники.
Правила Клейна-Гордона: определение порядка заполнения электронных оболочек

Согласно правилам Клейна-Гордона:
- Электроны заполняют энергетические уровни в порядке возрастания их энергии, начиная с наименьшего (ближайшего к ядру).
- На каждом уровне сначала заполняются подуровни с меньшей энергией (субуровни s, затем p, d, f).
- В пределах каждого подуровня электроны заполняют орбитали, начиная с самых низкоэнергетических и двигаясь к высшим.
- В рамках одной орбитали заполняются электроны парно с противоположными спинами.
Эти правила позволяют определить порядок электронного заполнения атомных оболочек и объясняют структуру периодической системы химических элементов. Используя правила Клейна-Гордона, ученые могут предсказать положение и количество электронов в оболочках атомов и строить электронные конфигурации всех элементов, что имеет большое значение для понимания свойств и реакций химических веществ и процессов.
| Номер оболочки | Общее число электронов | Электронная конфигурация |
|---|---|---|
| 1 | 2 | 1s2 |
| 2 | 8 | 2s2 2p6 |
| 3 | 8 | 3s2 3p6 |
| 4 | 18 | 4s2 3d10 4p6 |
| 5 | 18 | 5s2 4d10 5p6 |
| 6 | 32 | 6s2 4f14 5d10 6p6 |
Используя таблицу с порядком заполнения электронных оболочек, можно легко определить электронную конфигурацию любого химического элемента и его положение в периодической системе.
Принцип заполнения энергетических уровней: электронные конфигурации
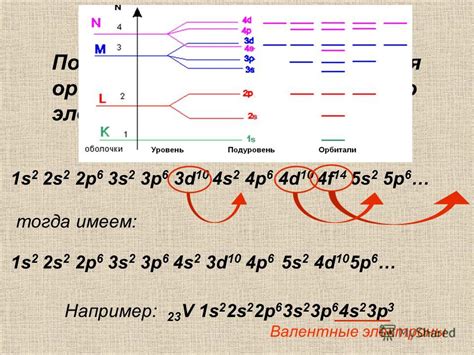
Электронная конфигурация атома описывает, как электроны распределены по энергетическим уровням и подуровням. Заполнение энергетических уровней атома происходит в соответствии с принципами заполнения.
Принцип заполнения энергетических уровней может быть сформулирован следующим образом:
- Наименьшие энергетические уровни заполняются электронами в первую очередь.
- При равных энергиях, подуровень с меньшим магнитным квантовым числом заполняется первым.
- Каждый электрон в атоме занимает свой собственный орбиталь, прежде чем они начнут заполнять орбитали парными электронами.
- Каждая орбиталь может вместить не более двух электронов с противоположным спином.
Электронная конфигурация атома может быть записана в виде последовательности чисел и букв, где числа обозначают энергетический уровень, а буквы обозначают подуровень. Например, электронная конфигурация атома кислорода может быть записана как 1s^2 2s^2 2p^4.
Знание принципов заполнения энергетических уровней и электронных конфигураций атомов позволяет понять свойства элементов и их химическое поведение.
Распределение электронов по орбиталям: основные правила и закономерности
Электроны в атоме распределены по энергетическим уровням, называемым орбиталями. Орбитали образуют оболочки, которые могут содержать разное количество электронов.
Основные правила и закономерности, которые определяют распределение электронов по орбиталям:
1. Принцип Клозе. Согласно этому принципу, электроны в атоме заполняют орбитали начиная с низших энергетических уровней и постепенно переходят к более высоким.
2. Правило Хунда. Принцип Хунда утверждает, что электроны с одинаковым спином (спин - квантовое свойство электрона) предпочтительно располагаются в разных орбиталях одного энергетического уровня, перед тем как заполнять орбитали с противоположным спином.
3. Закон запрета Паули. Согласно закону запрета Паули, в одной орбитали может находиться не более двух электронов, которые должны иметь противоположные спины.
Комбинируя эти правила, можно определить электронную конфигурацию атома, то есть количество электронов в каждой орбитали. Например, конфигурацию атома кислорода можно записать как 1s2 2s2 2p4: два электрона находятся в 1s-орбитали, два в 2s-орбитали и четыре в 2p-орбитали.
| Орбиталь | Обозначение | Максимальное количество электронов |
|---|---|---|
| s | spherica | 2 |
| p | principal | 6 |
| d | diffuse | 10 |
| f | fundamental | 14 |
Важно отметить, что орбиталя s может содержать только одну подорбиталь, в то время как орбитали p, d и f разделены на три, пять и семь подорбиталей соответственно.
Знание основных правил и закономерностей распределения электронов по орбиталям является важным для понимания электронной структуры атомов и определения их свойств. Это основа для изучения химии и объяснения различных химических реакций и связей между атомами.
Спин электрона: его значение и влияние на электронную структуру атома
Существует два возможных направления вращения электрона вокруг своей оси: "вверх" и "вниз". Каждому из этих направлений соответствует некоторая физическая величина, измеряемая в спиновых единицах (1/2). Таким образом, спин электрона может принимать только два значения: +1/2 и -1/2.
Влияние спина на электронную структуру атома проявляется в так называемом принципе запрещенных состояний Паули. Согласно этому принципу, в одном атоме не может находиться два электрона с одинаковыми значениями спина, но с разными значениями других квантовых чисел. Этот принцип является основой для строения электронных оболочек атомов.
Спин электрона также влияет на магнитные свойства атома. Когда электроны заполняют энергетические уровни, они формируют области, называемые магнитными моментами. Спины электронов в этих областях могут быть ориентированы в одном или противоположных направлениях, что определяет магнитные свойства вещества.
Таким образом, спин электрона играет важную роль в организации электронной структуры атома и определении его химических свойств. Понимание спина электрона и его влияния на атомарные процессы имеет большое значение для различных областей науки, включая квантовую физику, химию и материаловедение.