Электролиты представляют собой вещества, способные проводить электрический ток в растворенном или расплавленном состоянии. Однако, вопреки общему мнению, носителями электрического заряда в электролитах не являются свободные электроны, как это имеет место в металлах, а ионы.
Ионы – это атомы или группы атомов, имеющие положительный или отрицательный заряд. В электролитах можно встретить различные типы ионов. Например, в солевых электролитах встречаются положительные ионы металлов (катионы) и отрицательные ионы кислотных остатков (анионы). Водные растворы солей, такие как NaCl или MgSO4, содержат положительные ионы натрия, магния и отрицательные ионы хлорида, сульфата и т.д.
Именно при наличии ионов в электролитах возникает электрический ток. Под действием электрического поля ионы начинают двигаться в определенном направлении, образуя электрический ток. При проведении электрического тока через электролит, катионы (положительно заряженные ионы) движутся к аноду, а анионы (отрицательно заряженные ионы) – к катоду.
Электролиты - основные составляющие систем
Электролиты играют важную роль в различных системах и процессах, где возникают электрический заряд и проводимость. Присутствие электролитов позволяет передавать электрический заряд через растворы и проводы.
Основными составляющими системы электролитов являются положительно и отрицательно заряженные ионы. Электролиты могут быть как жидкими (растворы), так и твердыми (полупроводники).
Положительно заряженные ионы, называемые катионами, присутствуют в электролитах вследствие ионизации вещества. Отрицательно заряженные ионы, или анионы, также образуются в результате ионизации. Величина заряда ионов может быть различной и определяется свойствами вещества.
Важным свойством электролитов является проводимость. Проводимость электролитов определяется концентрацией ионов в растворе и их подвижностью. Более высокая концентрация ионов и их более высокая подвижность способствуют более высокой проводимости электролита.
Использование электролитов в различных системах позволяет осуществлять электролитические реакции, электрохимические процессы, а также регулировать рН-уровень раствора и электрофорез. Электролиты имеют широкое применение в различных областях, включая химическую промышленность, медицину и энергетику.
Ионы - ключевые элементы электролитов
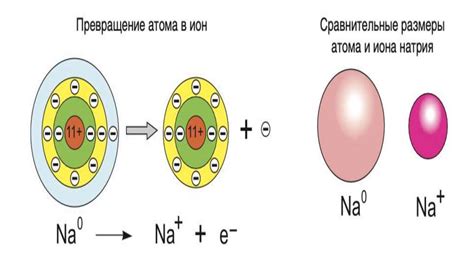
Ионы в электролитах образуются в результате процесса диссоциации или ионизации. При диссоциации молекулы электролита распадаются на положительно и отрицательно заряженные ионы. Например, при растворении хлорида натрия (NaCl) в воде, ион натрия (Na+) и ион хлора (Cl-) образуются в растворе.
Ионы, находясь в растворе электролита, могут свободно двигаться под действием электрического поля, что и позволяет электролиту проводить электрический ток. При подаче электрического тока ионы мигрируют к электродам, где происходят электрохимические реакции.
Таблица ниже представляет некоторые из наиболее распространенных ионов в электролитах:
| Положительные ионы (катионы) | Отрицательные ионы (анионы) |
|---|---|
| Натрий (Na+) | Хлор (Cl-) |
| Калий (K+) | Гидроксид (OH-) |
| Кальций (Ca2+) | Нитрат (NO3-) |
| Магний (Mg2+) | Сульфат (SO4^2-) |
| Аммоний (NH4+) | Ацетат (CH3COO-) |
Катионы и анионы: две стороны электролитов
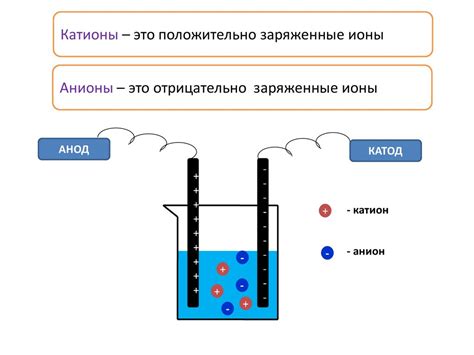
Катионы – положительно заряженные ионы, которые возникают при потере одного или нескольких электронов атомом или молекулой. Они ведут себя как металлы в растворе, перемещаясь к катоду, под положительным зарядом. Примерами катионов могут быть ионы натрия (Na+), калия (K+), магния (Mg2+) и так далее.
Анионы – отрицательно заряженные ионы, образующиеся при приобретении атомом или молекулой одного или нескольких электронов. Анионы перемещаются к аноду, имеющему отрицательный заряд. Некоторые примеры анионов включают ионы хлора (Cl-), гидроксида (OH-), нитрата (NO3-).
Катионы и анионы совместно обеспечивают проводимость электролита, поскольку их движение направлено в противоположные стороны. Электролиты используются в различных областях, включая батареи, электролиз, медицину и технологию.
Роль растворителей в проводимости электролитов

Растворители играют важную роль в проводимости электролитов. Они обладают способностью разрывать ионные связи между положительно и отрицательно заряженными частицами, образуя свободные ионы.
Когда электролит растворяется в растворителе, его молекулы или ионы диссоциируют, что приводит к образованию положительно заряженных катионов и отрицательно заряженных анионов. Эти свободные ионы способны перемещаться в растворителе и проводить электрический заряд.
Некоторые растворители обладают высокой проводимостью электролитов, так как они хорошо растворяют ионные соединения и обеспечивают быстрое разделение ионов. Другие растворители могут иметь низкую проводимость из-за своей структуры или химических свойств.
Растворители также могут влиять на скорость проводимости электролитов. Высокая температура растворителя может увеличить движение ионов и, следовательно, увеличить проводимость. Некоторые растворители могут также влиять на скорость обратной диссоциации электролита, что может снижать его проводимость.
Таким образом, выбор растворителя имеет значительное влияние на проводимость электролитов и может варьироваться в зависимости от химических свойств ионного соединения и растворителя.
| Роль растворителей в проводимости электролитов: |
|---|
| Обеспечивают диссоциацию электролитов на ионы |
| Создание свободных ионов |
| Позволяют ионам перемещаться и проводить электрический заряд |
| Влияют на скорость проводимости электролитов |
Соли - важные источники ионов

Соли играют важную роль во многих областях науки и технологий. Их используют в металлургии, химической промышленности, медицине, пищевой промышленности и т.д.
Соли образуются в результате реакции кислоты и основания, при которой выделяется вода и образуется ионная решетка. Ионы могут быть катионами (положительно заряженными) или анионами (отрицательно заряженными), и зависят от ионного радиуса и заряда.
Примеры солей включают хлорид натрия (NaCl), хлорид калия (KCl), сульфат магния (MgSO₄) и многие другие. Эти соединения различаются по составу и свойствам, и используются в различных отраслях научных исследований и промышленности.
Соли обеспечивают проводимость тока в электролитах, поскольку ионы оказываются свободными в растворе и способны перемещаться приложенному электрическому полю. Таким образом, соли являются основными носителями электрического заряда в электролитах.
| Название соли | Химическая формула | Свойства |
|---|---|---|
| Хлорид натрия | NaCl | Бесцветные кристаллы, хорошо растворим в воде |
| Сульфат магния | MgSO₄ | Белые кристаллы, растворимы в воде |
| Хлорид калия | KCl | Белые кристаллы, растворимы в воде |
Гетерогенные электролиты и их значимость
Гетерогенные электролиты используются в различных областях, начиная от батарей и аккумуляторов до электрохимических процессов. Они широко применяются в промышленности и научных исследованиях.
Главное значение гетерогенных электролитов заключается в их способности передвигаться в электрическом поле и перевозить заряды. Это свойство обусловлено наличием в электролите положительно и отрицательно заряженных частиц – ионов. Ионы передвигаются от области большей концентрации к области меньшей концентрации, что создает ток.
Гетерогенные электролиты имеют важное значение в электрохимических явлениях, таких как электролиз, гальванические элементы и фотоэлектрохимические процессы. Они позволяют проводить электрохимические реакции и генерировать электрическую энергию.
Исследования в области гетерогенных электролитов ведут к разработке новых материалов и технологий, улучшению электрохимических устройств и разработке более эффективных энергетических систем.
Применение электролитов в разных сферах науки и техники

Электролиты, являющиеся проводниками электрического заряда в растворах, имеют широкое применение в различных областях науки и техники. Вот некоторые из них:
- Электрохимия: Электролиты используются в электрохимических реакциях, таких как электролиз, гальванические элементы и аккумуляторы. Они играют важную роль в процессе передачи электричества через растворы, что позволяет электрохимическим реакциям происходить.
- Медицина: В медицинских приборах и процедурах электролиты используются для создания электролитических растворов и измерения уровня электролитов в организме. Это важно для поддержания деятельности клеток и функций органов.
- Электролитическая обработка материалов: Некоторые электролиты используются для обработки и изменения свойств материалов. Например, электролитическое окрашивание используется для создания защитных и декоративных покрытий на металлических поверхностях.
- Энергетика: В энергетической отрасли электролиты играют важную роль в аккумуляторах и топливных элементах. Они обеспечивают хранение и передачу электрической энергии.
- Электролитическая полимеризация: Электролиты могут быть использованы для проведения электролитической полимеризации, процесса, при котором мономеры образуют полимеры под воздействием электрического заряда. Это может быть использовано для создания полимерных пленок, мембран и других материалов.
Это лишь несколько примеров применения электролитов в разных областях науки и техники. Благодаря своим особенностям и способности проводить электрический заряд, электролиты продолжают находить все новые применения и способы использования в современном мире.