Экзо и эндотермические реакции - это два основных типа химических реакций, которые определяются изменением теплоты системы в процессе реакции. Эти реакции являются важными в химической науке и имеют широкий спектр применений в различных областях, включая промышленность и ежедневную жизнь.
Экзо и эндотермические реакции отличаются друг от друга по направлению переноса энергии. В экзотермических реакциях энергия освобождается из системы в окружающую среду, в то время как в эндотермических реакциях система поглощает энергию из окружающей среды. Эти реакции также различаются по знаку изменения энтальпии - в экзо термических реакциях энтальпия уменьшается, а в эндотермических реакциях энтальпия увеличивается.
Примером экзо термической реакции является сжигание древесины или горение бензина в двигателе внутреннего сгорания. В этих реакциях энергия освобождается в виде тепла и света. Например, при сжигании древесины происходит окисление углерода, освобождая большое количество тепла.
Эндотермические реакции также широко распространены в природе и технологиях. Например, поглощение солнечной энергии растениями в процессе фотосинтеза является эндотермической реакцией. В химической промышленности, эндотермические реакции могут использоваться для создания субстанций из элементов с высоким энергетическим потенциалом. Процесс превращения аммиака в нитрат аммония - один из примеров таких реакций.
Что такое экзо и эндотермические реакции
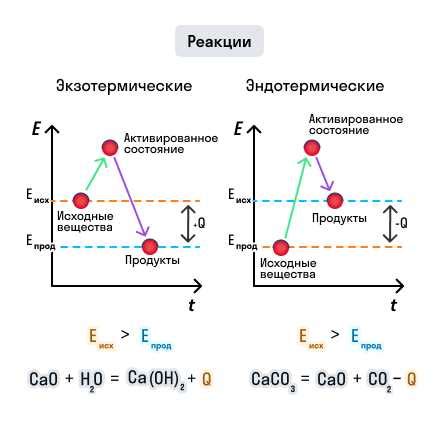
Экзотермическая реакция - это реакция, при которой выделяется тепло. В процессе экзотермической реакции теплота передается из реагентов в окружающую среду. Примерами таких реакций могут служить горение, разложение веществ, а также некоторые реакции обмена и синтеза. В ходе данных реакций энергия, выделяющаяся в виде тепла, часто способна вызывать эффект повышения температуры среды, в которой они происходят.
В отличие от экзотермических, эндотермические реакции требуют потребления энергии. Энергия поглощается реагентами из окружающей среды для осуществления данных химических превращений. При этом температура окружающей среды может снижаться. Примерами эндотермических реакций могут служить плавление льда, испарение жидкостей, а также некоторые фотохимические реакции.
Для более наглядного представления разницы между экзо и эндотермическими реакциями, рассмотрим таблицу:
| Тип реакции | Описание | Примеры |
|---|---|---|
| Экзотермическая | Реакция, при которой выделяется тепло в окружающую среду | Горение, зажигание спички |
| Эндотермическая | Реакция, при которой поглощается тепло из окружающей среды | Испарение воды, плавление льда |
Теплота реакции является важным аспектом в химии, так как она определяет термодинамические условия происходящих процессов и может иметь значительный эффект на саму реакцию. Понимание экзо и эндотермических реакций позволяет нам лучше понять энергетические аспекты химических изменений и использовать их в различных практических областях, таких как производство и энергетика.
Примеры экзотермических реакций

Вот несколько примеров экзотермических реакций, которые происходят с выделением тепла:
| Реакция | Описание |
|---|---|
| Горение | Процесс сжигания вещества в присутствии кислорода, при котором выделяется свет и тепло. Примеры включают горение дерева, бумаги, газа. |
| Взаимодействие кислоты и основания | Реакция между кислотой и основанием, при которой образуется соль и выделяется тепло. Например, реакция между соляной кислотой и гидроксидом натрия. |
| Кристаллизация | Процесс образования кристаллов из раствора или расплава, при котором выделяется тепло. Например, кристаллизация соли из водного раствора. |
| Реакция нейтрализации | Реакция между кислотой и основанием, при которой образуется соль и выделяется тепло. Например, реакция между соляной кислотой и гидроксидом натрия. |
| Реакция окисления | Реакция, при которой вещество теряет электроны и окисляющее вещество получает электроны. В результате такой реакции освобождается тепло. Примеры включают горение углерода и реакцию между металлом и кислородом. |
Экзотермические реакции играют важную роль в нашей жизни, так как многие из них используются в промышленных процессах и в повседневной химии.
Горение

При горении происходит сочетание горючего вещества с кислородом. Горючее вещество может быть как органическим (древесина, уголь, бензин), так и неорганическим (металлы, газы). Реакция горения происходит с выделением большого количества теплоты и света, что позволяет использовать горение в различных сферах деятельности человека: в производстве энергии, в кулинарии, для освещения и т.д.
Во время горения происходит ряд химических реакций между горючим веществом и кислородом, в результате которых образуется оксид с присутствием других продуктов, таких как вода, углекислый газ и дым. Реакция горения требует наличия кислорода и достаточной температуры для активации. Также для проведения горения могут быть необходимы катализаторы.
Горение подразделяется на три основных типа: пламенное, безпламенное и угловое. Пламенное горение является самым распространенным и характеризуется наличием пламени. Безпламенное горение происходит без образования пламени и характерно для некоторых горючих газов. Угловое горение происходит на поверхности твердых веществ, таких как уголь. В разных типах горения температура и скорость реакции могут отличаться, что влияет на эффективность и применение различных горючих веществ.
Горение является необратимым процессом и происходит до полного истощения горючего вещества и потери его способности к горению. При горении происходит выделение большого количества энергии, которая может быть использована в различных отраслях промышленности для производства тепла и электроэнергии.
| Примеры горения | Горючее вещество | Продукты горения |
|---|---|---|
| Горение древесины | Древесина | Углекислый газ, вода, пепел |
| Горение бензина | Бензин | Углекислый газ, вода, дым |
| Горение металлов | Металлы (например, магний) | Оксид металла |
Взрывы

Примерами взрывов могут служить взрывы динамита или других взрывчатых веществ. Динамит состоит из смеси тротила, нитроглицерина и других веществ, которые обладают высокой энергетической активностью. При поджигании динамита происходит быстрая окислительно-восстановительная реакция, при которой высвобождается огромное количество энергии в виде ударной волны, огня и газов.
Процесс взрыва имеет как полезное, так и опасное применение. Взрывы используются в строительстве и горнодобывающей промышленности для взрывания скальных пород или для разрушения зданий и сооружений. Однако неосторожное обращение с взрывчатыми веществами может привести к травмам и гибели.
Взрывы также возникают в химических реакторах при неуправляемом накоплении и выделении газов, что чревато авариями и катастрофами. Поэтому контроль и безопасность при проведении экзотермических реакций находятся в центре внимания ученых и инженеров.
Примеры эндотермических реакций

Примеры эндотермических реакций включают:
| Реакция | Объяснение |
|---|---|
| Разложение карбоната аммония (NH4CO3) | При ионизации карбоната аммония происходит поглощение тепла, что приводит к охлаждению окружающей среды. |
| Электролиз воды | В процессе электролиза воды энергия поставляется в виде электрического тока, что позволяет происходить реакции без нагревания окружающей среды. |
| Синтез аммиака (NH3) | При синтезе аммиака из азота и водорода поглощается большое количество энергии, что приводит к охлаждению окружающей среды. |
| Реакция растворения магния в серной кислоте (Mg + H2SO4) | Растворение магния в серной кислоте сопровождается поглощением тепла, что вызывает охлаждение окружающей среды. |
Эти примеры демонстрируют, как эндотермические реакции химических веществ могут приводить к охлаждению окружающей среды в результате поглощения тепловой энергии.
Испарение
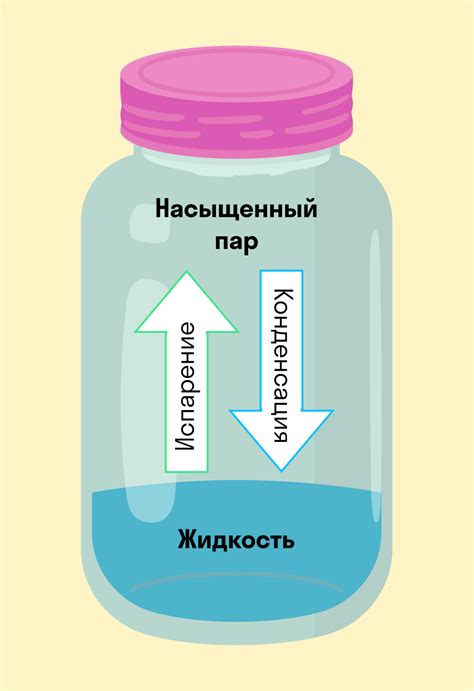
Во время испарения молекулы жидкости приобретают достаточно энергии, чтобы преодолеть силы притяжения и выйти за пределы жидкой фазы. Когда молекулы выходят из жидкости, они становятся свободными и движутся в пространстве как газовые молекулы.
Испарение происходит на поверхности жидкости и зависит от таких факторов, как температура, давление и площадь поверхности жидкости. При повышении температуры молекулы получают больше энергии и испарение происходит быстрее.
Испарение играет важную роль в природе. Он является основным механизмом образования облаков и выпадения осадков. Также испарение используется в промышленности для различных процессов, таких как обработка пищевых продуктов и производство химических веществ.
Для ускорения процесса испарения можно использовать такие методы, как нагревание жидкости, повышение поверхностного напряжения или увеличение площади поверхности контакта.
Испарение является важной частью водного круговорота, который поддерживает жизнь на Земле. Благодаря испарению, вода из океанов, рек и озер переходит состояние газа и поднимается в атмосферу, где затем конденсируется и образует облака, что впоследствии приводит к осадкам и запускает цикл снова. Без испарения, вода быстро исчезла бы с поверхности Земли.
Растворение

Растворы могут быть разных типов. Например, гомогенные растворы состоят из одной фазы, что значит, что частички растворенного вещества полностью смешаны с частицами растворителя. Примером гомогенного раствора является сольный раствор, где соль полностью растворяется в воде.
Другим типом раствора является негомогенный или суспензионный раствор. В нем распределение частиц растворенного вещества неравномерно. Например, молоко является суспензионным раствором, так как жирные капли не равномерно распределены в воде.
Растворение может быть эндотермическим или экзотермическим процессом. Во время эндотермического растворения, происходит поглощение тепла из окружающей среды, что приводит к охлаждению раствора. Например, растворение некоторых солей или бакарбоната аммония является эндотермическим процессом.
В экзотермическом растворении, наоборот, происходит выделение тепла, что приводит к нагреванию раствора. Примером такого процесса может быть растворение кислоты в воде.
Растворение является важным процессом во многих отраслях науки и промышленности. Оно используется для получения растворов различных веществ, а также для различных химических реакций.
Плавление

При плавлении молекулы или атомы вещества приобретают достаточно энергии для преодоления сил внутренней связи и начинают двигаться свободно друг относительно друга. В результате образуется жидкость, в которой молекулы действуют на друг друга слабыми полями притяжения и отталкивания, образуя более близкий порядок, чем в газах, но не такой же, как в твердых веществах.
Когда твердое вещество нагревается, его тепловая энергия повышается, причем температура растет. Когда достигается температура плавления, дальнейшее добавление тепла больше не приводит к изменению температуры, а переходит в преотрывание связей и плавление вещества.
Примером плавления является расплавленное стекло. Когда стекло нагревается до своей температуры плавления, оно становится жидким, что позволяет формировать его в различные формы. После охлаждения оно снова превращается в твердое состояние.
Важно отметить, что для разных веществ температура плавления различна. Некоторые вещества имеют очень низкую температуру плавления, такие как лед, который плавится при 0°C, и азот, который плавится при -195.8°C. Другие вещества, например, алюминий, имеют гораздо более высокую температуру плавления, равную 660°C.
Таким образом, плавление является процессом, при котором твердое вещество становится жидким при достижении своей температуры плавления. Это важное явление, используемое в различных отраслях науки, промышленности и повседневной жизни.
Объяснение экзотермических и эндотермических реакций

Экзотермические реакции являются такими химическими реакциями, в которых выделяется тепло, энергия передается из системы реагентов в окружающую среду. Это означает, что в процессе реакции энергия освобождается и реакция отдает тепло. Примером экзотермической реакции может быть сжигание древесины или топлива, при котором энергия освобождается в виде тепла и света.
С другой стороны, эндотермические реакции происходят, когда энергия поглощается в процессе химической реакции. В этих реакциях соединения поглощают энергию из окружающей среды для преобразования реагентов в продукты. Примером эндотермической реакции может быть поглощение тепла при смешивании химических реагентов для получения холодного пакета или холодного компресcа от лекарственного бандажа.
Отличие экзотермических и эндотермических реакций в направлении теплового эффекта является ключевым понятием для понимания энергетических потоков в химических системах. Экзотермические реакции являются самостоятельными и могут использоваться для производства тепла или электричества, в то время как эндотермические реакции потребляют энергию и обычно требуют внешнего источника тепла или энергии для их совершения.
- Экзотермические реакции выделяют тепло.
- Пример экзотермической реакции - сжигание древесины.
- Эндотермические реакции поглощают тепло.
- Пример эндотермической реакции - поглощение тепла при смешивании реагентов.
- Экзотермические реакции могут использоваться для производства тепла или электричества.
- Эндотермические реакции требуют внешнего источника тепла или энергии.



