Строение вещества - это основа для понимания основных свойств и взаимодействий различных материалов в нашей жизни. Все вещества вокруг нас, будь то вода, воздух, металлы или пластик, обладают своими уникальными химическими и физическими свойствами, которые происходят из их атомного и молекулярного строения.
Атомы - это минимальные частицы вещества, состоящие из ядра, окруженного электронами. Тип и количество атомов в материале определяют его химический элемент. Например, вода состоит из атомов кислорода и водорода, обозначаемых символами O и H. Строение молекулы воды имеет форму буквы V, где кислородный атом находится в центре, а два водородных атома расположены по бокам.
Молекулы представляют собой группировку атомов, связанных друг с другом по определенным правилам через химические связи. Существуют различные типы химических связей, такие как ковалентная, ионная и металлическая связи, которые определяют структуру и свойства вещества.
Кристаллическая структура - это особый вид строения материалов. В кристаллических веществах атомы или молекулы расположены в регулярной и повторяющейся трехмерной решетке. Примером кристаллической структуры является алмаз, где каждый атом углерода связан с другими атомами в форме геометрической фигуры. В отличие от кристаллических веществ, аморфные материалы не обладают регулярной структурой, и их атомы или молекулы располагаются более хаотично.
Строение атомов: основные компоненты

Электроны - это элементарные частицы, которые обращаются вокруг ядра атома. Они имеют отрицательный заряд и массу, примерно 2000 раз меньшую, чем у протонов и нейтронов. Электроны располагаются на энергетических уровнях, которые определяют их удаленность от ядра.
Протоны - это частицы, имеющие положительный заряд и массу, примерно равную массе нейтронов. Протоны находятся в ядре атома и определяют его химические свойства. Количество протонов в атоме определяет его атомный номер, он является уникальным для каждого химического элемента.
Нейтроны - это частицы, не имеющие заряда, но имеющие массу, примерно равную массе протонов. Они также находятся в ядре атома вместе с протонами и служат для удерживания ядра вместе.
Строение атомов является основой для понимания химических и физических свойств вещества. Взаимодействие электронов, протонов и нейтронов определяет его массу, заряд, стабильность и возможность образовывать химические соединения.
Электроны, протоны и нейтроны
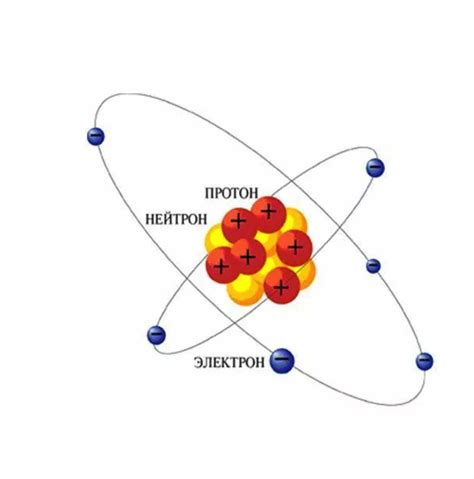
Электроны - отрицательно заряженные элементарные частицы, которые вращаются по орбитам вокруг ядра атома. Они имеют очень малую массу по сравнению с протонами и нейтронами. Количество электронов в атоме определяет его химические свойства и определяет его положение в периодической таблице элементов.
Протоны - положительно заряженные элементарные частицы, которые находятся в ядре атома. Они имеют массу, примерно равную массе нейтрона, но заряд протона равен по абсолютной величине заряду электрона. Количество протонов в атоме определяет его атомный номер и определяет его тип элемента.
Нейтроны - нейтральные элементарные частицы, которые находятся в ядре атома. Они имеют массу, примерно равную массе протона, но не имеют заряда. Количество нейтронов в атоме может варьироваться, и атом с определенным количеством нейтронов называется изотопом.
Вместе эти три частицы образуют строение вещества и определяют его свойства и поведение. Понятие о разном количестве электронов, протонов и нейтронов в разных атомах позволяет производить различные соединения и реакции, что обеспечивает многообразие веществ и их свойств в нашем мире.
Химические связи: мосты между атомами
Важными типами химических связей являются ионные связи, ковалентные связи и металлические связи.
Ионные связи образуются между атомами с положительным и отрицательным зарядом. Один атом отдает электроны, становясь положительно заряженным ионом, а другой атом принимает эти электроны, становясь отрицательно заряженным ионом. Эти заряженные ионы притягиваются друг к другу и образуют ионные соединения с характерными свойствами, такими как высокая температура плавления и легкость растворения в воде.
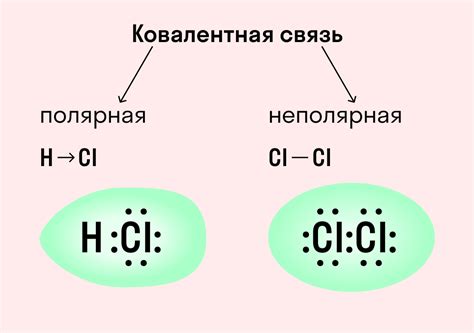
Ковалентные связи образуются, когда атомы делят электроны, чтобы достичь стабильной электронной конфигурации. В ковалентной связи электроны образуют пары и общую электронную оболочку между атомами. Ковалентные связи могут быть полярными или неполярными, в зависимости от разности в электронной плотности между атомами. Ковалентные соединения обладают различными свойствами, включая низкую температуру плавления и хорошое растворение в органических растворителях.
Металлические связи характерны для металлов, где электроны свободно перемещаются между атомами. Подобно ковалентным связям, металлические связи образуют общую электронную оболочку. Металлические связи обуславливают высокую теплопроводность и электропроводность у металлов, а также их способность быть гибкими и деформируемыми без разрушения.
Химические связи являются основой для понимания строения вещества и объяснения их свойств. Понимание различных типов химических связей помогает прогнозировать поведение и реактивность веществ в различных условиях, а также разработать новые материалы и соединения с определенными свойствами.
Ковалентные, ионные и металлические связи
Строение вещества определяется типом связи между его атомами. В химии выделяют три основных типа связей: ковалентные, ионные и металлические.
- Ковалентные связи образуются между атомами, когда они обменивают электроны. В результате образуется пара электронов, которая связывает атомы в молекулу. Ковалентные связи характерны для многих органических и неорганических соединений.
- Ионные связи возникают между атомами, когда один атом отдает электрон(ы), а другой атом принимает его. В результате образуется положительный ион и отрицательный ион, которые притягиваются друг к другу. Ионные связи характерны для солей и большинства неорганических соединений.
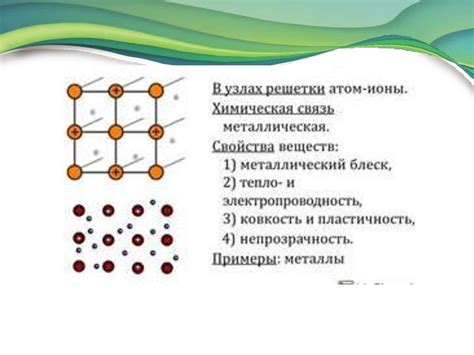
- Металлические связи характерны для металлов. В металлах электроны свободно перемещаются по всей структуре, образуя так называемое "электронное море". Это обеспечивает металлам хорошую электропроводность и теплопроводность.
Понимание различных типов связей между атомами позволяет более глубоко изучать свойства веществ и применять их в различных областях науки и техники.
Молекулы: образование сложных структур

Молекулы, состоящие из атомов, могут объединяться в сложные структуры, образуя различные вещества. Взаимодействие атомов при формировании молекул определяется химическими связями.
Химические связи между атомами могут быть ковалентными или ионными. В случае ковалентной связи, атомы делят пару электронов, что позволяет им быть связанными внутри молекулы. При ионной связи, атомы обмениваются электронами, образуя положительно и отрицательно заряженные ионы, которые притягиваются друг к другу.
Образование сложных структур происходит путем соединения молекул друг с другом через химические связи. В результате образуются макромолекулы, такие как полимеры или биомолекулы. Полимеры образуются при повторении одного и того же молекулярного блока, называемого мономером. Биомолекулы, в свою очередь, играют важную роль в биологических процессах и включают в себя ДНК, РНК, белки и углеводы.
Сложные молекулярные структуры обладают уникальными свойствами и функциями, которые определяют их роль в различных областях науки и технологий. Например, полимеры широко используются в производстве пластмасс, текстиля, лекарственных препаратов и других материалов. Биомолекулы играют решающую роль в биохимических процессах организма и являются основой для разработки новых лекарств и технологий в медицине.
Понимание образования сложных структур на молекулярном уровне является ключевым фактором для развития новых материалов и технологий. Изучение свойств и взаимодействий молекул позволяет улучшить существующие процессы и создать новые принципы для улучшения качества жизни и развития науки в целом.
Полярность, форма и свойства молекул
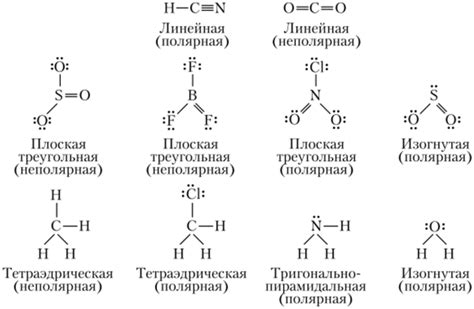
Молекулы веществ могут быть полярными или неполярными в зависимости от разности электроотрицательностей атомов, составляющих молекулу. Полярные молекулы имеют разделение зарядов и обладают дипольным моментом, в то время как неполярные молекулы не имеют разделения зарядов.
Форма молекулы также оказывает влияние на ее свойства. При изменении формы молекулы, например в результате вращения одного или нескольких атомов, меняются химические и физические свойства вещества.
Полярность и форма молекулы влияют на такие свойства молекулы, как ее растворимость, плотность, температура плавления и кипения, скорость реакции и другие физико-химические характеристики. Например, полярные молекулы обычно легко растворяются в полярных растворителях, таких как вода, в то время как неполярные молекулы растворяются лучше в неполярных растворителях, например в органических растворителях.
Таким образом, понимание полярности, формы и свойств молекул позволяет более глубоко изучить химические процессы и построение соединений, а также понять множество явлений, связанных с взаимодействием молекул веществ.
Решетки: порядок в кристаллических веществах
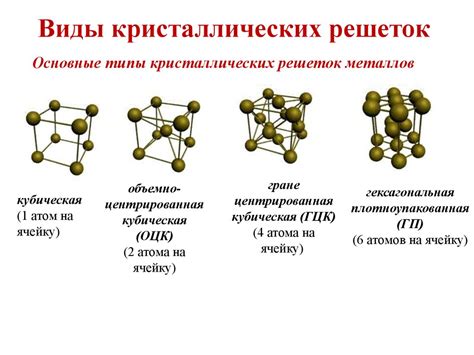
Кристаллические решетки можно представить в виде трехмерной сетки, в узлах которой располагаются атомы, ионы или молекул. Расстояние между узлами в решетке называется межрешеточным расстоянием. Оно обычно определяется радиусами атомов или ионов, а также типом химической связи между ними.
Симметрия решеток определяется группой пространственных симметрий. Существует 230 различных типов симметрии решетки, которые объединены в 14 Бравэ-сеток. Бравэ-сетки классифицируются по форме и углам их ячеек.
Кристаллические решетки обладают периодической структурой, то есть их структура повторяется в пространстве бесконечное число раз. Это позволяет определять точное расположение атомов, ионов или молекул в решетке и описывать ее свойства в математической форме.
Решетки являются основой для понимания и изучения структуры и свойств кристаллических веществ. Они играют важную роль в таких областях науки и техники, как материаловедение, химия, физика и биология.
| Бравэ-сетка | Примеры веществ |
|---|---|
| Кубическая простая | Алмаз, натрий хлорид |
| Гексагональная | Графен, гексагональное пиритное |
| Тетрагональная | Титан диоксид, станиолит |
| Орторомбическая | Слюды, аметист, бабеттит |