Химия - удивительная наука, изучающая состав, свойства и превращения веществ. В основе химии лежит понятие химической реакции, которая является основным механизмом превращения одних веществ в другие. Химические реакции происходят в нашей жизни повсюду: от обычного дыхания до взрывных реакций.
Химическая реакция - это процесс, в ходе которого происходят перестройки и изменения молекул. В результате химической реакции образуются новые вещества с другими свойствами. Главное отличие химической реакции от физического явления заключается в том, что химическая реакция нереверсивна - восстановление исходных веществ практически невозможно.
Химические реакции классифицируются по различным признакам. Один из основных критериев - это вид веществ, участвующих в реакции. В зависимости от этого, химические реакции могут быть классифицированы как органические, неорганические и биохимические.
Органические реакции происходят с органическими веществами, то есть соединениями углерода. Это может быть синтез новых органических веществ или их разложение. Органические реакции широко применяются в промышленности, фармацевтике, косметологии и других отраслях.
Понятие химической реакции

Химические реакции могут происходить под воздействием различных факторов, таких как температура, давление, концентрация реагентов, наличие катализаторов и т.д. Существует множество различных типов химических реакций, каждый из которых характеризуется определенными особенностями и свойствами.
Химические реакции классифицируются по различным признакам, например, по типу протекающих процессов, изменению состояния агрегации веществ, изменению окислительно-восстановительного состояния, обмену ионами и другим параметрам. Классификация химических реакций позволяет упорядочить и систематизировать их многообразие для лучшего понимания.
Химические реакции являются основным объектом изучения химии. Они применяются во многих областях, таких как промышленность, медицина, пищевая промышленность, энергетика и другие. Понимание и умение анализировать и проводить химические реакции является важным для понимания процессов в природе и создания новых веществ и материалов.
Основные классификации химических реакций

Химические реакции могут быть классифицированы по различным признакам. Рассмотрим несколько основных классификаций: по типу реагентов, по виду протекания и по изменению энергии.
1. Классификация по типу реагентов:
Реакции соединения - реагенты объединяются в одно соединение (A + B → AB).
Реакции разложения - соединение распадается на более простые компоненты (AB → A + B).
Реакции замещения - один элемент или группа замещается другим элементом или группой (AB + C → AC + B).
Реакции двойного разложения - происходит обмен ионами между реагентами (AB + CD → AD + CB).
2. Классификация по виду протекания:
Прямые реакции - продукты образуются непосредственно из реагентов (A + B → C).
Обратимые реакции - реагенты образуются из продуктов (C → A + B).
Катализируемые реакции - протекают при наличии катализатора, который ускоряет реакцию, но не участвует в ней.
Автокаталитические реакции - реакционная смесь обладает автокаталитическими свойствами, то есть сама способствует ускорению реакции.
3. Классификация по изменению энергии:
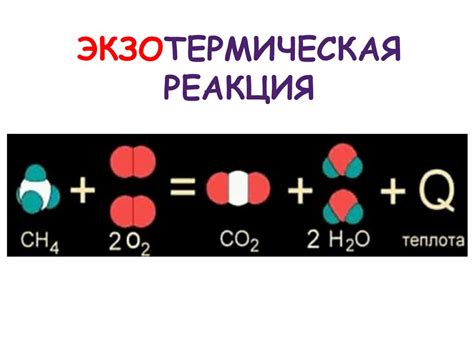
Экзотермические реакции - освобождается энергия (тепло, свет) (A + B → C + тепло).
Эндотермические реакции - поглощается энергия (тепло) (A + B + тепло → C).
Апротермические реакции - без изменения температуры (A + B → C).
Вышеуказанные классификации помогают упорядочить и категоризировать химические реакции по различным характеристикам. Это позволяет более глубоко изучать и понимать происходящие процессы и применять их в различных областях науки и промышленности.
Экзотермические реакции

В ходе экзотермической реакции энергия обычно выделяется в виде тепла, но может быть выделена и в других формах, таких как свет, звук или механическое движение.
Такие реакции обычно сопровождаются повышением температуры среды или окружающей среды, а также могут проявляться в виде пламени или тепловыделения.
Примеры экзотермических реакций включают воспламенение древесины, горение бумаги, сжигание топлива и окисление металлов.
Такие реакции играют важную роль в жизни на Земле, так как многие из них происходят внутри нашего организма и обеспечивают необходимую энергию для различных биологических процессов.
Экзотермические реакции обычно идут самоподдерживающимся процессом, то есть высвобождение энергии в ходе реакции поддерживает дальнейший протекание реакции.
Особенностью экзотермических реакций является их способность подогревать окружающую среду или инициировать другие реакции. Некоторые из них используются в промышленности, например, в процессе сжигания топлива для получения энергии или при производстве различных химических веществ.
Контрольные вопросы по экзотермическим реакциям

- Что такое экзотермическая реакция?
- В чем отличие экзотермической реакции от эндотермической?
- Каково значение энергии активации в экзотермической реакции?
- Какие типы экзотермических реакций существуют?
- Какие факторы могут влиять на скорость экзотермической реакции?
- Каковы основные характеристики экзотермической реакции?
- Какие примеры экзотермических реакций можно привести из окружающей среды?
- Имеют ли экзотермические реакции значение в промышленности или медицине?
Эндотермические реакции
Примерами эндотермических реакций могут служить процессы плавления льда, испарения жидкости, разложения нитратов и др. Все эндотермические реакции требуют постоянного поступления энергии, чтобы они могли протекать.
Чтобы определить, является ли реакция эндотермической, можно провести эксперимент, измерив изменение температуры в процессе ее протекания. Если температура окружающей среды увеличивается в ходе реакции, то реакцию можно назвать экзотермической. Если же температура понижается, то реакцию можно назвать эндотермической.
Эндотермические реакции играют важную роль в различных сферах, таких как промышленность, энергетика и даже в биологических процессах. Знание об эндотермических реакциях позволяет улучшить технологические процессы, увеличить эффективность и экономичность производства.
Изучение и понимание эндотермических реакций является важной частью химического образования. Эти реакции помогают установить линии обратимости химических процессов и теплообмена в природе. Они также играют роль в создании новых материалов и разработке новых технологий, что способствует развитию науки и техники.
Важно помнить, что эндотермические реакции возможны благодаря наличию активирующей энергии. Без ее постоянного обеспечения эндотермические процессы прекращаются.
Контрольные вопросы по эндотермическим реакциям

- Что такое эндотермическая реакция?
- Какие факторы могут способствовать протеканию эндотермической реакции?
- Какие примеры эндотермических реакций вы можете привести?
- Какова роль катализаторов в эндотермических реакциях?
- Как эндотермические реакции влияют на окружающую среду?
Эти вопросы помогут вам лучше понять суть эндотермических реакций и их значение в химии и промышленности. Знание этих концепций позволит вам более глубоко вникнуть в мир химических превращений и их классификаций.
Обратимые реакции

Обратимые реакции можно представить в виде равновесного состояния, где скорость протекания прямой и обратной реакций одинакова. В таком случае, все компоненты системы находятся в динамическом равновесии.
Примером обратимой реакции может служить реакция образования и распада воды:
- Прямая реакция: 2H2O → 2H2 + O2
- Обратная реакция: 2H2 + O2 → 2H2O
Такие реакции особенно важны в биологических системах, где равновесие между прямой и обратной реакцией позволяет управлять процессами в организме и поддерживать динамическое равновесие.
Знание обратимых реакций является ключевым для понимания протекания химических процессов и разработки новых технологий в различных областях, таких как фармацевтика, энергетика, пищевая промышленность и др.
Контрольные вопросы по обратимым реакциям

- Что такое обратимая химическая реакция?
- Какие факторы влияют на обратимость реакции?
- Какие механизмы обратимой реакции существуют?
- Какие условия необходимы для достижения равновесия в обратимой реакции?
- Что такое обратимая реакция первого порядка?
- Какие термодинамические условия делают реакцию обратимой?
- Как сдвигается равновесие в обратимой реакции при изменении концентрации или давления реагентов?
- Какие методы можно использовать для измерения скорости обратимых реакций?
- Какие примеры обратимых реакций могут быть интересными для исследования и применения в промышленности?



