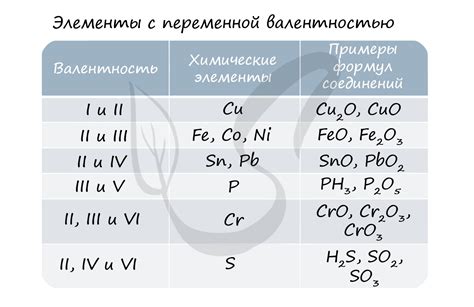
Понятие валентности в химии является одним из важнейших понятий, позволяющих понять свойства и химическую активность элементов и соединений. Валентность – это способность атомов элементов образовывать химические связи с другими атомами. Она определяет количество электронов, которые атом может отдать или принять во время химической реакции.
Валентность может быть положительной или отрицательной, в зависимости от того, электроны что атомы отдают или принимают. Чаще всего валентность определяется по количеству валентных электронов во внешней оболочке атома. Обычно, атомы стремятся заполнить свою внешнюю оболочку, чтобы достичь стабильного электронного состояния, имеющего благоприятный энергетический характер.
Примерами валентности в химии могут служить такие элементы, как кислород и водород. Например, водород имеет валентность +1, так как он может отдать свой единственный валентный электрон и образовать положительный ион H+. Кислород, в свою очередь, имеет валентность -2, так как он способен принять два электрона и образовать отрицательные ионы O2-. Такие примеры помогают понять, как элементы могут участвовать в химических реакциях и образовывать соединения.
Валентность в химии: что это такое?
Валентность играет важную роль в химии, так как позволяет предсказать возможные соединения, реакционную способность и физические свойства вещества. Обычно валентность связана с расположением внешних электронов атома, которые называются валентными электронами.
Валентность может быть положительной или отрицательной и обозначается римскими цифрами и знаком + или - соответственно. Например, валентность атома кислорода в воде (H2O) равна -2, а в случае катиона аммония (NH4+) валентность азота составляет -3.
Определение валентности атома помогает в построении формул химических соединений и понимании их структуры. Например, молекула углекислого газа (CO2) состоит из атома углерода с валентностью +4 и двух атомов кислорода с валентностью -2 каждый.
Валентность может быть изменена при проведении химической реакции, что ведет к образованию новых соединений. Примером такой реакции является образование солей, где ионы с разной валентностью могут взаимодействовать.
Важно отметить, что валентность – это концепция, которая основана на идеализированной модели связей в химических соединениях. В реальности, электроны могут быть распределены неоднородно и валентность может изменяться в различных условиях.
История открытия и развития понятия валентности

История открытия и развития понятия валентности начинается во второй половине XIX века. В 1852 году французский химик Амедео Авогадро предложил гипотезу о равном объеме газов при одинаковых условиях температуры и давления, в которой была введена идея молекул и атомов как отдельных частиц.
Следующий важный вклад в развитие понятия валентности был сделан русским химиком Александром Бутлеровым. В 1869 году он предложил классификацию органических соединений на основе концепции валентности. Бутлеров провел анализ большого количества химических соединений и открыл закономерности в их структуре и связях между атомами.
В дальнейшем понятие валентности было уточнено и развито другими учеными, такими как Лоскар Онгер и Левис Н .М. Понятие "валентность" стало ключевым для объяснения молекулярной структуры и связей в химических соединениях.
Современное представление о валентности основывается на электронной строении атомов и молекул. Валентность атома определяется количеством внешних электронов, которые он может отдать или принять при формировании химических связей. Эта концепция является ключевой для понимания химических реакций и образования различных веществ.
Таким образом, история открытия и развития понятия валентности связана с развитием химической науки и является одним из фундаментальных понятий в химии. Понимание валентности позволяет ученым предсказывать свойства и поведение химических веществ и применять эту информацию в различных областях науки и технологий.
Основные принципы валентности
1. Валентность атома может быть определена по числу его электронов во внешней электронной оболочке. Валентные электроны находятся на самом внешнем энергетическом уровне атома и ответственны за образование химических связей. Число валентных электронов часто совпадает с номером группы элемента в периодической таблице;
2. Максимальная валентность атома зависит от его внешней электронной конфигурации. Некоторые элементы, такие как кислород или сера, имеют фиксированную максимальную валентность, определенную их электронной конфигурацией. Другие элементы могут иметь несколько различных валентностей, определяемых их способностью принимать или отдавать электроны;
3. Валентность может быть определена по структурной формуле молекулы. Структурная формула представляет собой графическое изображение молекулы, показывающее типы и количество связей между атомами. Анализ структурной формулы позволяет определить валентность атомов;
4. Валентность атома может изменяться в рамках реакций. При химических реакциях атомы могут приобретать или терять электроны, что влияет на их валентность. Например, хлор может иметь валентность -1 или +1 в зависимости от того, является ли он отрицательно или положительно заряженным атомом;
5. Валентность атома связана с его реакционной способностью. Атомы с высокой валентностью обладают большей реакционной способностью, так как они могут образовывать связи с большим количеством атомов. Это позволяет им образовывать более сложные структуры и участвовать в более разнообразных реакциях.
Основные принципы валентности в химии являются важными для понимания основных принципов образования и характеристик химических связей и молекулярных структур. Знание валентности позволяет предсказывать поведение атомов и молекул в различных химических реакциях и способствует разработке новых соединений и материалов.
Связь валентности с расположением элементов в Периодической системе
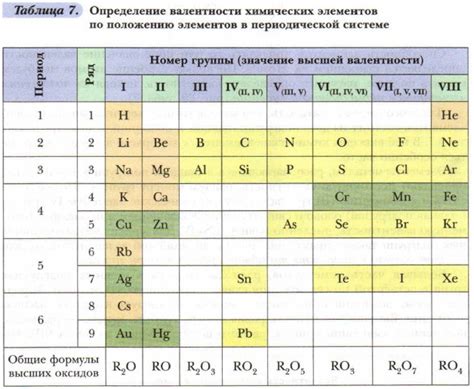
Расположение элементов в Периодической системе может дать нам представление о валентности элемента. Валентность химического элемента определяет количество электронов, которые атом этого элемента может отдать или принять во время химической реакции.
Валентность элементов, расположенных в одной группе Периодической системы, обычно одинаковая. Например, все элементы первой группы (щелочные металлы) имеют валентность +1, так как они имеют один электрон во внешней энергетической оболочке, который они готовы отдать. Аналогично, элементы второй группы (щёлочноземельные металлы) имеют валентность +2, так как у них два электрона во внешней энергетической оболочке.
Однако, с увеличением периода количество внешних электронов и валентность элементов увеличивается. Например, элементы первого периода имеют валентность от +1 до +4, второго периода – от +2 до +5, третьего периода – от +3 до +6 и так далее.
Также, валентность элементов может изменяться в зависимости от окислительных состояний элемента. Некоторые элементы, такие как железо (Fe) и медь (Cu), могут образовывать несколько ионов с разной валентностью.
| Группа | Валентность |
|---|---|
| 1 | +1 |
| 2 | +2 |
| 3 | +3 |
| 4 | +4 |
| 5 | +5 |
| 6 | -2 |
| 7 | -1 |
| 8 | 0 |
Таким образом, валентность элемента в химической реакции определяется его положением в Периодической системе, электронной конфигурацией и окислительным состоянием элемента.
Примеры валентности в химических соединениях
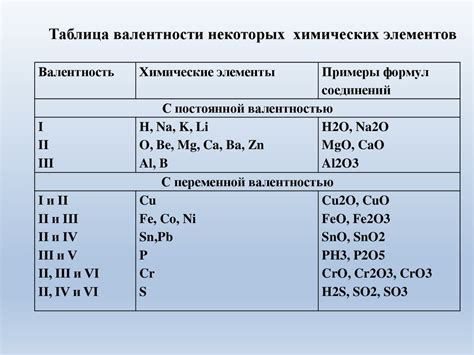
1. Водород (H2) - валентность водорода составляет 1, так как атом водорода имеет один электрон, готовый отдать или принять.
2. Кислород (O2) - валентность кислорода составляет 2, так как атомы кислорода готовы принять 2 электрона от других атомов.
3. Соляная кислота (HCl) - валентность хлора в данном соединении составляет 1, так как он может принять один электрон от атома водорода.
4. Аммиак (NH3) - валентность азота в данном соединении составляет 3, так как он способен принять 3 электрона от трех атомов водорода.
5. Углекислый газ (CO2) - валентность кислорода в данном соединении составляет 4, так как он способен принять 2 электрона от каждого атома углерода.
Это лишь некоторые примеры, где проявляется валентность, их много больше. Валентность играет ключевую роль в понимании связей между атомами в химических соединениях и помогает определить, какие элементы могут образовывать стабильные соединения.
Значение валентности в химических реакциях

В химических реакциях валентность атомов определяет, как они смогут связываться с другими атомами, образуя стабильные молекулы. Валентность также указывает на количество электронов, которые атом может отдать или принять для формирования химической связи.
Например, кислород (O) имеет валентность 2, что означает, что он может образовывать две связи с другими атомами. Водород (H) имеет валентность 1, поэтому может образовывать только одну связь. Как результат, водород может образовывать молекулу воды, где два атома водорода образуют связи с одним атомом кислорода.
Значение валентности также помогает понять химические реакции, так как они основаны на принципе сохранения валентности. Во время химической реакции атомы перестраивают свои связи, чтобы достичь стабильного электронного состояния. Важно знать валентность атомов, чтобы предсказать, какие химические связи будут образовываться или разрушаться в результате реакции.
Изучение валентности атомов позволяет химикам понять, как происходят различные химические реакции, и помогает в разработке новых веществ и материалов с определенными свойствами. Понимание значений валентности является основой для изучения химии и применения ее в различных областях науки и технологии.