Классификация химических реакций - это процесс, который помогает понять и систематизировать разнообразные типы и виды химических превращений веществ. Химические реакции происходят в нашей повседневной жизни и в природе, и понимание их классификации помогает нам разобраться во множестве химических процессов, которые окружают нас.
Важно отметить, что классификация химических реакций необходима для лучшего понимания основных принципов и законов химии. Она позволяет установить связь между различными типами реакций и классифицировать их по ряду факторов, таких как изменение состояния веществ, образование или разрушение связей, изменение энергии и так далее.
В 8 классе ученикам предлагается познакомиться с основными типами реакций, которые они будут изучать в течение всего курса химии. Это включает реакции с образованием осадков, окислительно-восстановительные реакции, реакции с кислотами и щелочами, газообразные реакции и др. Каждый тип реакции имеет свои особенности и требует определенного уровня понимания со стороны учеников.
Основные принципы классификации химических реакций 8 класс
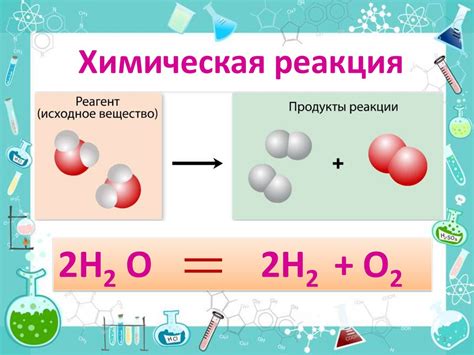
Одним из основных принципов классификации химических реакций является тип веществ, участвующих в реакции. Реакции могут происходить между металлами и неметаллами, между кислотами и основаниями, между кислотами и металлами и другими типами веществ. Каждый тип реакции имеет свои особенности и требует определенных условий для протекания.
Другим принципом классификации химических реакций является изменение состояния веществ. Реакции могут быть обратимыми или необратимыми, и они могут происходить в различных агрегатных состояниях веществ - в газообразной, жидкой или твердой форме.
Также реакции могут быть классифицированы по энергетическим изменениям. Реакции могут быть экзотермическими, когда выделяется энергия, или эндотермическими, когда поглощается энергия. Это также важный аспект понимания химических реакций и их классификации.
И, наконец, классификация химических реакций может быть основана на изменении химического состава веществ. Реакции могут быть синтезом, когда происходит образование нового вещества, разложением, когда вещество распадается на составные компоненты, замещением, когда одни атомы или группы атомов замещаются другими, и двойным обменом, когда происходит обмен элементами между реагентами.
В главных чертах, эти принципы классификации химических реакций помогают структурировать и понять различные типы реакций и их особенности. На основе этих принципов учащиеся 8 класса могут легче усваивать новые знания в области химии и применять их на практике.
Реакции с образованием вещества
Реакции с образованием вещества могут происходить между различными веществами: между элементами, между соединениями и элементами, между молекулами и ионами.
Обычно реакции с образованием вещества представляют собой декомпозицию или синтез. В декомпозиции из одного вещества образуются два или более новых вещества. В синтезе из двух веществ образуется одно новое вещество. Другие типы реакций с образованием вещества включают аддицию и полимеризацию.
- Декомпозиция - это реакция, при которой одно вещество распадается на два или более новых вещества. Примером может быть реакция распада воды на кислород и водород: 2H2O → 2H2 + O2.
- Синтез - это реакция, при которой два или более вещества объединяются для образования одного нового вещества. Примером может быть реакция синтеза воды из водорода и кислорода: 2H2 + O2 → 2H2O.
- Аддиция - это реакция, при которой два или более вещества объединяются без образования новых веществ. Примером может быть реакция аддиции хлора и метана: CH4 + Cl2 → CH3Cl + HCl.
- Полимеризация - это реакция, при которой мономеры объединяются в полимерную цепь, образуя полимерное вещество. Примером может быть реакция полимеризации этилена: nCH2=CH2 → (CH2CH2)n.
Реакции с образованием вещества играют важную роль в химии и имеют широкий спектр приложений. Они позволяют синтезировать новые материалы, производить химические реакции и участвовать в метаболизме живых организмов.
Реакции с разложением вещества

Реакции с разложением вещества могут проходить в разных условиях: при нагревании, при взаимодействии с другими веществами, при действии света или электричества.
Примером реакции с разложением вещества может служить разложение воды на водород и кислород под действием электрического тока. Уравнение этой реакции выглядит следующим образом:
2H2O -> 2H2 + O2
В результате разложения воды образуется молекулярный водород и молекулярный кислород.
Реакции с разложением вещества являются важной составляющей многих процессов в природе и промышленности. Они позволяют получать различные вещества, а также происходить распаду сложных органических соединений.
Ученикам необходимо изучать разные виды реакций, в том числе и реакции с разложением вещества, для того чтобы лучше понять принципы и законы химических превращений.
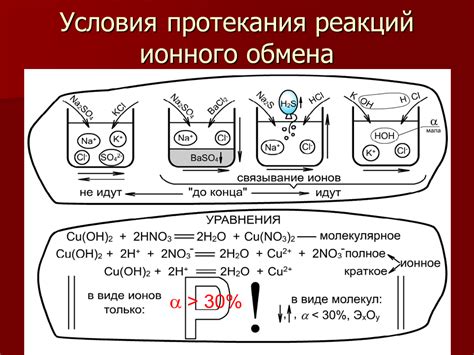
Реакции с обменом веществами
Основными типами реакций с обменом веществами являются:
- Реакция с образованием соли
- Реакция с образованием оксида
- Реакция с образованием кислоты
- Реакция с образованием основания
В реакции с образованием соли происходит обмен между металлом и неметаллом, где металл замещает водород в кислоте, образуя соль и выделяя водород. Примером такой реакции может быть реакция между магнием и соляной кислотой:
Mg + 2HCl -> MgCl2 + H2
В реакции с образованием оксида вещества соединяются с кислородом и образуют соответствующие оксиды. Например, реакция горения магния:
2Mg + O2 -> 2MgO
Реакция с образованием кислоты происходит, когда неметалл соединяется с кислородом и образует кислоту. Пример такой реакции:
SO2 + H2O -> H2SO3
В реакции с образованием основания натрий или калий реагируют с водой, образуя гидроксид и выделяя водород. Пример реакции:
2Na + 2H2O -> 2NaOH + H2
Реакции с обменом веществами важны для понимания принципов химической реакции и возможности предсказания ее продуктов.
Реакции, сопровождающиеся изменением окислительно-восстановительного состояния

Окислительное и восстановительное вещества образуют окислитель-восстановительную пару. Окислитель – вещество, при взаимодействии с которым другое вещество уходит в восстановление (уменьшение окислительно-восстановительного числа). Восстановитель – вещество, при взаимодействии с которым другое вещество уходит в окисление (увеличение окислительно-восстановительного числа).
В реакциях окисления и восстановления происходит изменение окислительно-восстановительного числа элементов веществ. Окислитель и восстановитель могут быть элементами или соединениями.
Примеры реакций, сопровождающихся изменением окислительно-восстановительного состояния:
| Реакция | Окислитель | Восстановитель |
|---|---|---|
| 2Na + Cl2 → 2NaCl | Cl2 | Na |
| Zn + 2HCl → ZnCl2 + H2 | HCl | Zn |
| 2Fe2+ + Cl2 → 2Fe3+ + 2Cl- | Cl2 | Fe2+ |
В первой реакции хлор (Cl2) окисляет натрий (Na), при этом сам восстанавливается до ионов хлорида (Cl-). Во второй реакции соляная кислота (HCl) окисляет цинк (Zn), в результате образуется хлорид цинка (ZnCl2) и выделяется водород (H2). В третьей реакции хлор (Cl2) окисляет ион железа (Fe2+), формируя ионы железа (Fe3+) и ионы хлорида (Cl-).
Знание основных реакций окисления и восстановления позволяет понять механизмы химических превращений и участвующие в них вещества.
Реакции нейтрализации

Основной признак реакции нейтрализации – образование воды и соли. Кислоты и щелочи, участвующие в реакции, называются исходными веществами. В результате реакции образуются продукты – соль и вода.
Распознать реакцию нейтрализации можно по следующим признакам:
- образование воды
- образование соли
- возможное образование газа
- изменение pH реакционной среды
Примеры реакций нейтрализации:
- Соляная кислота (HCl) + гидроксид натрия (NaOH) → хлорид натрия (NaCl) + вода (H2O)
- Серная кислота (H2SO4) + гидроксид кальция (Ca(OH)2) → сульфат кальция (CaSO4) + вода (H2O)
- Угольная кислота (H2CO3) + гидроксид аммония (NH4OH) → карбонат аммония (NH4)2CO3 + вода (H2O)
Реакции нейтрализации широко применяются в жизни и промышленности. Например, реакция между соляной кислотой и гидроксидом натрия используется для получения поваренной соли. Также нейтрализационные реакции играют важную роль в процессе пищеварения в организме человека.
Реакции с образованием осадка
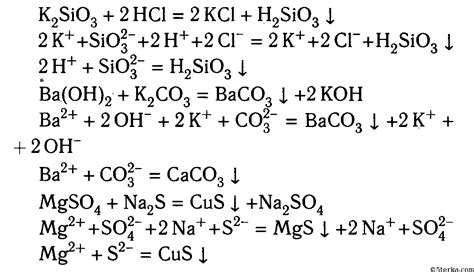
Осадок образуется, когда реагенты взаимодействуют и образуют новые соединения, которые не растворяются в данной среде и выпадают в виде нерастворимого вещества. В этом случае осадок может быть как видимым глазом, так и микроскопическим.
Реакции с образованием осадка часто применяются для очистки воды от токсичных и вредных веществ, а также для получения чистых продуктов в лаборатории. Такие реакции могут иметь различные механизмы и проходить по разным уравнениям.
Примером реакции с образованием осадка может служить реакция между раствором хлорида натрия (NaCl) и раствором серебряного нитрата (AgNO3). При взаимодействии этих реагентов образуется белое осадочное вещество – хлорид серебра (AgCl), которое не растворяется в воде.
- Натрий хлорид (NaCl) + Серебряный нитрат (AgNO3) → Хлорид серебра (AgCl) + Нитрат натрия (NaNO3)
Реакции с образованием осадка основаны на принципе нерастворимости веществ. Для того чтобы определить, будет ли осадок образовываться в реакции, необходимо знать растворимость реагентов и продуктов реакции.
Различные соли и соединения могут иметь разную степень растворимости в воде. Эту информацию можно найти в специальных таблицах растворимости, которые содержат данные о том, в каком виде и в каком количестве вещество может раствориться в данной среде.
Реакции с образованием осадка являются важной темой в изучении химии и имеют широкую практическую применимость. Они позволяют не только получать новые вещества, но и определять наличие или отсутствие определенного вещества в смеси или растворе.
Комплексные реакции

Одним из примеров таких реакций является реакция с образованием сложных ионов. В ходе таких реакций ионы разных соединений образуют комплексы, которые могут быть стабильными или временными.
Комплексные реакции часто встречаются в органической химии, где множество реагентов и реакций могут привести к образованию сложных продуктов. Еще одним примером комплексных реакций в органической химии является синтез биологически активных веществ, таких как лекарственные препараты.
Понимание комплексных реакций важно для изучения химии на более глубоком уровне и позволяет лучше понять сложные химические процессы, которые происходят в нашей жизни.