Газом называется одно из агрегатных состояний вещества, которое отличается от твердого и жидкого состояний. В качестве примера газа можно привести воздух, который нас окружает. В физике для 7 класса важно понимать, что газы состоят из отдельных частиц, называемых молекулами, которые находятся в постоянном движении.
Когда частицы газа двигаются, они сталкиваются между собой и со стенками сосуда, в котором газ находится. Эти столкновения создают давление газа. Давление газа зависит от количества и скорости движения частиц, а также от объема сосуда.
Закон Бойля гласит, что при неизменной температуре количество газа увеличивается при уменьшении его объема, а количество газа уменьшается при увеличении объема. Это означает, что при уменьшении объема газа, его частицы будут чаще сталкиваться друг с другом и со стенками сосуда, что приведет к увеличению давления газа.
Изучение газов является важной частью школьного курса физики для 7 класса. Понимание основных понятий и законов, связанных с газами, позволяет объяснить множество явлений в природе и применять полученные знания в реальной жизни.
Свойства и состояние газа в физике

Свойства газа определяют его состояние и поведение при изменении давления, температуры и объема. Основные свойства газа включают:
1. Давление. Газы оказывают давление на стены сосудов, в которых они находятся. Давление газа определяется силой, с которой молекулы газа сталкиваются со стенками сосуда.
2. Температура. Температура газа характеризует скорость движения молекул и их энергию. При повышении температуры газ нагревается и его молекулы начинают двигаться быстрее.
3. Объем. Газы не имеют определенного объема и полностью заполняют ими занимаемое пространство. Объем газа можно изменить путем изменения давления или температуры.
4. Плотность. Плотность газа характеризует его массу, содержащуюся в единице объема. Плотность газа зависит от его молекулярной массы и давления.
5. Вязкость. Вязкость газа определяет его способность сопротивляться деформации и текучести. Некоторые газы, такие как воздух, обладают низкой вязкостью, а некоторые газы, например пар, обладают высокой вязкостью.
6. Растяжимость. Газы являются растяжимыми и способны расширяться под воздействием тепла или сжиматься при изменении давления.
Изучение свойств газа позволяет узнать о его поведении в различных условиях. Это знание широко применяется в различных областях науки и техники, таких как аэродинамика, физическая химия, метеорология и многое другое.
Определение газа и его особенности

Основные особенности газа:
- Газ занимает объем, соответствующий объему сосуда, в котором он находится.
- Газ может рассеиваться и расширяться без ограничений, заполняя все доступное пространство.
- Молекулы газа находятся в постоянном движении, сталкиваются и обмениваются энергией при соударениях.
- Газ обладает давлением, которое возникает в результате столкновений молекул газа с стенками сосуда.
- Газы обладают различными физическими свойствами, такими как запах, цвет, плотность и т.д.
Важно отметить, что свойства газа сильно зависят от давления и температуры, что позволяет использовать его в различных областях нашей жизни, от бытовых нужд до промышленных процессов.
Давление газа и его измерение

Одним из таких инструментов является барометр - прибор, который используется для измерения атмосферного давления. Барометр состоит из ртути и закрытой трубки, один конец которой открыт к атмосфере, а другой погружен в столб ртути. В результате разности давлений ртути, уровень ее в трубке меняется. Измеряя эту разность, можно определить атмосферное давление.
Для измерения давления газа в закрытом сосуде можно использовать манометр. Манометр состоит из двух частей - открытой и закрытой. В закрытой части находится газ, давление которого нужно измерить. В открытой части находится другой газ, обычно воздух. Если давление в закрытой части выше, то газ будет перемещаться в открытую часть, изменяя уровень жидкости или газа. Измеряя эту разность уровней, можно определить давление газа в закрытом сосуде.
Для более точного измерения давления газа могут использоваться различные единицы измерения, такие как паскаль (Па) или миллиметр ртути (мм рт. ст.). Паскаль - это единица измерения давления в Международной системе (СИ), а миллиметр ртути - единица, используемая в барометрах.
Измерение давления газа является важным понятием в физике и имеет много практических применений, как в научных исследованиях, так и в различных технических областях.
Зависимость давления газа от объема
Согласно закону Бойля-Мариотта, при постоянной температуре объем газа изменяется пропорционально обратно его давлению. Другими словами, если давление газа увеличивается, то его объем уменьшается, и наоборот.
Для наглядного представления этой зависимости можно составить таблицу или построить график, отображающий изменение давления и объема газа.
Закон Бойля-Мариотта может быть описан следующей формулой:
P₁ × V₁ = P₂ × V₂
где P₁ и V₁ - начальное давление и объем газа, а P₂ и V₂ - конечное давление и объем газа.
Закон Бойля-Мариотта имеет большое практическое значение и находит применение в различных областях, включая химию, физику и технику. Он позволяет предсказывать изменение объема или давления газа при известном изменении одной из этих величин и посчитать неизвестную величину.
Знание этого закона помогает понять и объяснить многие физические и химические явления, а также справиться с практическими задачами, связанными с газами.
Температура и объем газа
Взаимосвязь между температурой и объемом газа основана на законе Шарля. Согласно этому закону, при постоянном давлении объем газа прямо пропорционален его температуре.
Это означает, что если температура газа увеличивается, то его объем также увеличивается, а при уменьшении температуры газа его объем уменьшается. При этом пропорциональность можно описать уравнением:
V1 / T1 = V2 / T2
где V1 и T1 - исходный объем и температура газа, а V2 и T2 - измененный объем и температура газа.
При повышении температуры газ расширяется, так как молекулы движутся быстрее и занимают больше места. А при понижении температуры газ сжимается, так как молекулы движутся медленнее и занимают меньше места.
Знание этой взаимосвязи между температурой и объемом газа позволяет предсказывать изменения объема в зависимости от изменения температуры и наоборот. Также это является основой для объяснения многих физических явлений, связанных с газами.
Идеальный газ и уравнение состояния

Идеальный газ - это газ, обладающий рядом особенностей, которые позволяют упростить его описание и анализ в рамках физических законов. В идеальном газе не происходят ни притяжения, ни отталкивания между его молекулами. Это значит, что молекулы идеального газа считаются точками массы, не имеющими размеров и взаимного влияния.
Для описания идеального газа используется уравнение состояния идеального газа, которое называется уравнением Менделеева-Клапейрона:
PV = nRT
где P - давление газа, V - его объем, n - количество вещества газа в молях, R - универсальная газовая постоянная, T - температура газа в Кельвинах.
Уравнение Менделеева-Клапейрона позволяет связать основные величины, характеризующие идеальный газ, и найти неизвестные параметры, если заданы остальные величины. Используя это уравнение, можно рассчитать давление, объем или температуру газа в различных условиях.
Идеальный газ является абстракцией, так как на практике реальные газы всегда отклоняются от идеального поведения при высоких давлениях и низких температурах. Однако, для большинства практических задач идеальное газовое уравнение является приближенно точным и широко используется в физике и химии.
Превращение газов и фазовые переходы
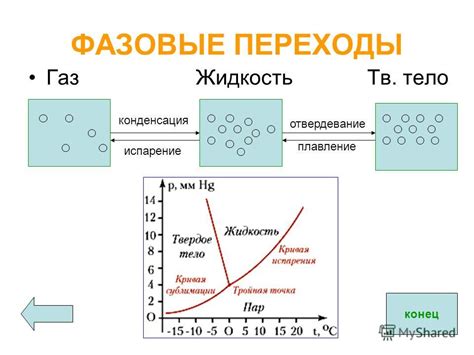
Газы могут претерпевать различные превращения и фазовые переходы в зависимости от изменения температуры и давления. Рассмотрим основные виды превращений газов:
- Испарение: это процесс, при котором жидкость превращается в газ при определенной температуре и давлении.
- Конденсация: наоборот, это процесс, при котором газ превращается в жидкость, когда его охлаждают или давление повышается.
- Сублимация: это превращение твердого вещества прямо в газ, минуя фазу жидкости.
- Десублимация: сублимация в обратном направлении - процесс превращения газа в твердое вещество.
Фазовые переходы также играют важную роль в поведении газов:
- Изобарный переход: происходит при постоянном давлении и изменении температуры. Примером изобарного перехода является плавление или кипение вещества.
- Изотермический переход: происходит при постоянной температуре и изменении давления. Например, сжатие или расширение газа.
- Изохорный переход: возникает при постоянном объеме и изменении температуры или давления. Примером может служить сохранение газа в закрытой емкости.
Понимание превращений газов и фазовых переходов позволяет ученым и инженерам контролировать и использовать свойства газов для различных целей, например, в промышленных и научных процессах.
Применение газов в жизни и промышленности

Газы играют важную роль в нашей жизни и промышленности. Они широко применяются в различных сферах и выполняют разнообразные функции. Вот некоторые из них:
- Энергетика: газ используется в качестве топлива для генерации электроэнергии. Он сжигается в электростанциях, чтобы получить тепло, которое затем используется для привода турбин и генерации электричества. Газовая энергетика является одним из самых чистых и эффективных способов получения энергии.
- Отопление: газ также используется для обогрева жилых и коммерческих помещений. Газовые отопительные системы обеспечивают комфортную температуру в помещении и являются одним из наиболее распространенных способов обогрева.
- Транспорт: газ может быть использован в качестве топлива для автомобилей и других транспортных средств. Это особенно актуально в случае автомобилей с двигателем внутреннего сгорания на газе (газобаллонное оборудование), которые могут быть более экологичными и экономичными по сравнению с обычными автомобилями.
- Промышленность: газы широко используются в промышленности в различных процессах. Например, газы могут быть использованы в качестве сырья для производства различных химических веществ, включая пластик, удобрения и лекарственные препараты. Они также используются в металлургии для нагрева и обработки металлов.
- Медицина: некоторые газы играют важную роль в медицинской практике. Например, кислород используется для поддержания дыхания пациентов в больницах, а азот окружающей среды используется для создания среды, защищающей чувствительные материалы и медицинское оборудование от воздействия кислорода и влаги.
Однако, несмотря на все преимущества, использование газов также имеет свои недостатки и риски. Например, неправильное использование и хранение газов может привести к авариям и несчастным случаям. Поэтому очень важно соблюдать все правила безопасности и использовать газы с осторожностью.
Значение газа для природы и экологии
Во-первых, газы, такие как кислород и углекислый газ, необходимы для поддержания жизни на планете. Кислород является основным источником дыхания для людей, животных и многих видов растений. Углекислый газ, в свою очередь, является основным регулятором температуры в атмосфере и выполняет ключевую роль в процессе фотосинтеза растений.
Во-вторых, некоторые газы играют важную роль в защите от опасных излучений. Озоновый слой в стратосфере является естественным фильтром ультрафиолетовых излучений, защищая живые организмы от их вредного влияния. Озоновый слой образуется благодаря воздействию солнечных лучей на молекулы кислорода.
Также газы оказывают влияние на климатические процессы. В атмосфере сосредоточены такие газы, как пары воды, метан, оксиды азота и диоксид серы, которые являются парниковыми газами и способствуют удержанию тепла в атмосфере. Это явление называется парниковым эффектом и оно играет важную роль в регуляции температуры на Земле.
Однако, современные промышленные процессы и деятельность человека приводят к увеличению выбросов парниковых газов и разрушению озонового слоя, что негативно сказывается на природе и экологии. Поэтому важно принимать меры для сокращения выбросов газов, внедрять экологически чистые технологии и бережно относиться к природным ресурсам.