В атоме, электрон движется по орбиталям - областям пространства, где с высокой вероятностью можно найти электрон. Орбитали обладают своими особыми характеристиками и именами, которые помогают в классификации электронных оболочек.
Существует несколько видов орбиталей - s, p, d, f. Орбиталь s представляет собой сферу вокруг ядра, в которой электрон может находиться. Она не имеет никаких определенных ориентаций и обладает формой сферы. Орбиталь s может содержать максимум два электрона.
Орбитали p имеют форму грушевидной фигуры с двумя полюсами, расположенными вдоль главных осей. Каждая главная ось соответствует одной из осей пространства. Орбитали p могут быть ориентированы по трем направлениям, соответствующим трём ортогональным осям. Таким образом, орбитали p могут включать в себя до шести электронов.
Орбитали d обладают более сложной формой, состоящей из двух полос и кольца вокруг ядра. Они приобретают форму пяти различных ансамблей, каждый из которых может содержать максимум 10 электронов.
Орбитали f имеют форму горошкастой фигуры с четырьмя половинками. Они также могут быть ориентированы по разным направлениям в пространстве. Орбитали f могут вмещать до 14 электронов.
Что такое орбиталь электрона и каковы его названия?
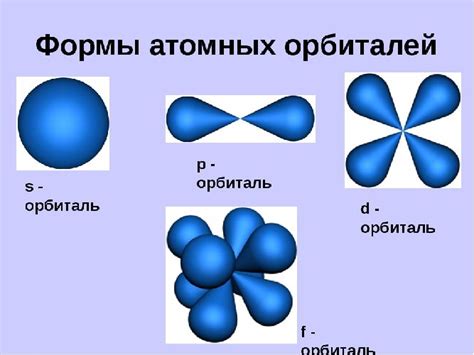
Орбитали классифицируются по форме, размеру и ориентации в пространстве. Они обозначаются буквами латинского алфавита и цифрами.
| Орбиталь | Обозначение | Форма | Ориентация |
|---|---|---|---|
| С | 1s | Сферическая | Нет |
| Р | 2p | Двудольная | X, Y, Z |
| Д | 3d | Комплексная | X, Y, Z |
Например, орбиталь 1s обозначает сферическую орбиталь первого электрона, 2p – двудольную орбиталь второго электрона и т.д.
Орбитали также отличаются энергетическим уровнем. Орбитали с наименьшей энергией располагаются ближе к ядру, а орбитали с более высокой энергией – дальше.
Знание орбиталей и их названий является основополагающим в квантовой механике и является ключом к пониманию электронной структуры атома и его свойств.
Основные понятия
- Субуровень энергии: каждая орбиталь имеет свой субуровень энергии, который определяет ее стабильность и расположение относительно других орбиталей. Самый нижний субуровень имеет наименьшую энергию и обозначается буквой s, затем идут побочные субуровни p, d и f.
- Основной уровень: орбитали с одинаковым основным уровнем содержат одинаковую энергию. Они обозначаются целыми числами - 1, 2, 3 и т.д. Чем выше основной уровень, тем больше орбиталей он содержит.
- Форма орбиталей: орбитали имеют определенную форму, которую можно представить как объемную область. Например, орбиталь s является сферической, орбитали p имеют форму шестирубежника.
- Электронное строение: распределение электронов между орбиталями в атоме. Оно определяется правилами заполнения орбиталей, такими как правило паули и правило Гунда.
История открытия

Представление о физической природе орбиталей было существенно расширено в 1920-х и 1930-х годах, когда была разработана квантовая механика. Квантовая механика описывает электроны не как частицы, движущиеся по определенным траекториям, а как вероятностные объекты, существующие в виде волновых функций. Орбитали электрона были впервые рассчитаны в 1920-х годах Шрёдингером и в конце 1920-х – Гейзенбергом. Они разработали математическую аппаратуру, позволяющую распределить электрон в пространстве вокруг ядра с определенной вероятностью.
Орбитали электрона имеют различные формы – сферические, плоские кольца, шарообразные клубки и так далее. Каждой форме орбитали соответствует определенное энергетическое состояние электрона. Современное понимание атомной структуры и электронных орбиталей базируется на квантовой механике и является одной из основных основ атомной физики.
| Ученый | Год |
|---|---|
| Нильс Бор | 1913 |
| Эрвин Шрёдингер | 1920-е годы |
| Вернер Гейзенберг | 1920-е годы |
Вещественные орбитали
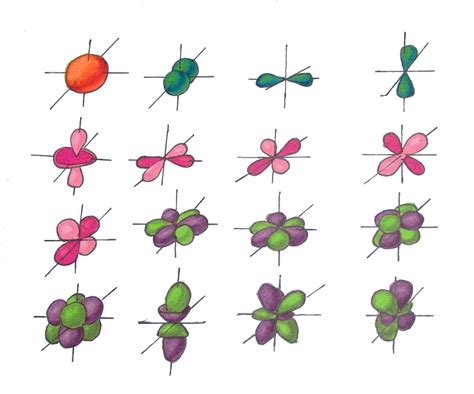
В отличие от простых вещественных чисел, электронные орбитали включают комплексные числа в своем описании. Комплексная часть функции описывает фазу электрона и его квантовое состояние.
Вещественные орбитали обычно обозначаются буквами s, p, d, f и т.д. Каждая буква обозначает форму орбитали, а число перед ней указывает на главный квантовый числовой уровень.
Орбитали типа s имеют форму сферы и симметричны относительно центрального ядра. Они имеют самую низкую энергию и наименьшие радиальные вероятности нахождения электрона вблизи ядра.
Орбитали типа p обладают формой двух симметричных по отношению друг к другу лопастей, направленных вдоль осей координат, проходящих через ядро. Они имеют три различные ориентации - px, py и pz.
Несколько более сложными являются орбитали типа d и f. Они имеют более сложные формы и ориентации, включая петли и узлы. Они обычно используются для описания более сложных молекул и атомов.
Уровни энергии электронов
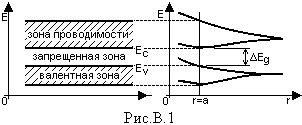
Электроны, находящиеся в атомах, занимают различные энергетические уровни. Уровни энергии электронов представляют собой сферические области вокруг ядра, где вероятность нахождения электрона наиболее высока.
Уровни энергии обозначаются буквами английского алфавита с использованием строчных и прописных символов. Наиболее низкий энергетический уровень обозначается буквой s, затем следуют уровни p, d и f.
Каждый энергетический уровень может содержать несколько подуровней. Первый энергетический уровень (s) имеет один подуровень, второй (p) - три, третий (d) - пять, а четвертый (f) - семь. Подуровни обозначаются числами, начиная с 1.
Каждый подуровень может содержать определенное количество электронов. Первый энергетический уровень может вмещать до 2 электронов (s-подуровень). Второй - до 8 (s-подуровень) и 6 (p-подуровень). Третий - до 18 (s-подуровень), 10 (p-подуровень) и 6 (d-подуровень). Четвертый - до 32 (s-подуровень), 14 (p-подуровень), 10 (d-подуровень) и 7 (f-подуровень).
Энергетические уровни и подуровни электронов позволяют описывать и объяснять свойства и поведение атомов, а также их способность вступать в химические реакции.
Правила Хунда

Согласно этим правилам, электроны заполняют орбитали в следующем порядке:
- Сначала заполняются орбитали с наименьшей энергией.
- На одной орбитали может находиться не более двух электронов, которые должны иметь противоположный спин.
- Орбитали заполняются по принципу максимальной мультипликативности, то есть сначала заполняются орбитали с наименьшим значением полного спина.
- Если на орбитали есть выбор, то она заполняется так, чтобы у электронов был максимальный значительный проекционный квантовый числовой момент на орбитальный сам вектор.
- Если несколько орбиталей имеют одинаковую энергию и доступны для заполнения, то каждая орбиталь заполняется одним электроном, прежде чем заполнение происходит с электронами второго спина.
Правила Хунда позволяют ученным предсказывать и определять электронную структуру атомов, а также объяснять различные свойства и химическую активность элементов.
Названия орбиталей
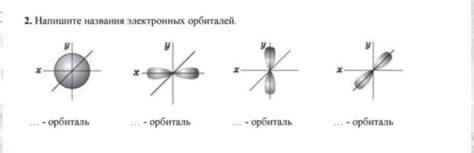
В атоме существуют несколько типов орбиталей, каждая из которых имеет свои названия и форму.
1. s-орбиталь (шарообразная форма) – эта орбиталь имеет форму сферы и находится ближе всего к ядру атома.
2. p-орбитали (щупальцеобразная форма) – это три орбитали, которые имеют форму двуполюсника и расположены вдоль трех осей X, Y и Z.
3. d-орбитали (двухщупальцевая форма) – это пять орбиталей, которые имеют более сложную форму и расположены в плоскости X, Y и в диагональных направлениях.
4. f-орбитали (сложная форма) – это семь орбиталей, которые имеют еще более сложную форму и расположены в различных трехмерных областях пространства.
Это названия основных типов орбиталей, которые могут быть представлены в атоме. Каждая орбиталь имеет свои конкретные энергии и заполняется электронами согласно правилам заполнения.