Оксид фосфора - это химическое соединение, состоящее из фосфора и кислорода. Его формула обычно обозначается как P2O5. Это бесцветные кристаллические вещества, которые нерастворимы в воде, но легко реагируют с другими веществами.
Реакция оксида фосфора с различными соединениями может привести к образованию различных продуктов. Как правило, реакция оксида фосфора с веществами с высоким содержанием воды приводит к образованию фосфорной кислоты (H3PO4). Фосфорная кислота является важным соединением в химической промышленности и используется в производстве удобрений, стекла, мыла и многих других продуктов.
Оксид фосфора также может реагировать с металлами, образуя фосфиды. Фосфиды могут быть стабильными или нестабильными в зависимости от металла и условий реакции. Например, реакция оксида фосфора с алюминием приводит к образованию алюминиевого фосфида (AlP), который является стабильным соединением. Алюминиевый фосфид используется в производстве пиротехнических смесей и пирофорных зажигателей.
Вещества, реагирующие с оксидом фосфора

В данной статье рассмотрим некоторые из веществ, реагирующих с оксидом фосфора:
- Вода (H2O): Взаимодействие оксида фосфора с водой приводит к образованию ортофосфорной кислоты (H3PO4). Данная реакция является экзотермической, то есть сопровождается выделением тепла. Кроме того, при взаимодействии оксида фосфора с водой образуются кислый и щелочной растворы, содержащие ионы H2PO4- и HPO42-.
- Натрий (Na): Оксид фосфора реагирует с натрием с образованием натриевого фосфида (Na3P), который является сильным основанием. Данная реакция протекает при нагревании оксида фосфора со внедрением металла в его структуру.
- Кислород (O2): При нагревании оксида фосфора с кислородом происходит обратимая реакция, в результате которой образуются оксид фосфора (P2O5) и диоксид фосфора (P4O10). Данный процесс называется окислением оксида фосфора и применяется в синтезе различных соединений фосфора.
- Аммиак (NH3): Взаимодействие оксида фосфора с аммиаком приводит к образованию соли аммония (NH4)3PO4. Эта реакция является экзотермической и часто используется в промышленности для получения фосфатных удобрений.
Это лишь некоторые примеры веществ, которые могут взаимодействовать с оксидом фосфора. В реальности существует множество других соединений и элементов, которые могут вызывать различные реакции с этим оксидом. Изучение этих реакций позволяет расширить наше понимание о свойствах и возможностях оксида фосфора, а также применять его в различных областях науки и промышленности.
Оксиды металлов
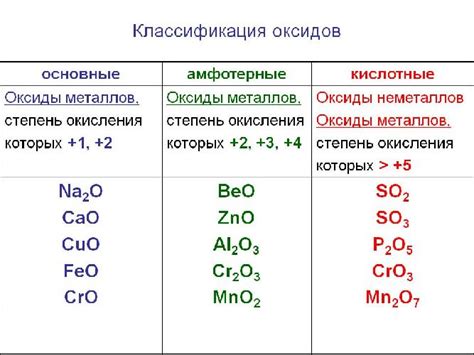
Оксиды металлов представляют собой химические соединения, состоящие из металла и кислорода. Они широко распространены в природе и играют важную роль в различных процессах.
Оксиды металлов могут образовываться при реакции металла с кислородом или при окислении металла. Некоторые из них имеют крайне высокую температуру плавления и являются очень прочными материалами.
Оксиды металлов имеют различные свойства и применяются в различных отраслях промышленности. Например, оксид алюминия (Al2O3) используется в производстве стекла, керамики и абразивов. Оксид железа (Fe2O3) является основным компонентом ржавчины и используется в производстве красителей и магнитов.
Таблица ниже представляет несколько примеров оксидов металлов и их химические формулы:
| Металл | Оксид | Химическая формула |
|---|---|---|
| Алюминий | Оксид алюминия (алюминат) | Al2O3 |
| Железо | Оксид железа (ржавчина) | Fe2O3 |
| Медь | Оксид меди (медь (II) оксид) | CuO |
| Свинец | Оксид свинца (охра) | PbO |
Оксиды металлов могут образовывать различные соединения и иметь различную химическую активность. Изучение их свойств позволяет использовать их в различных областях науки и технологии.
Водород

Водород широко используется в промышленности. Он используется в процессе получения аммиака, который является сырьем для производства удобрений. Водород также используется для производства масла и жира, пластика и резины, водородного топлива и других продуктов.
Водород применяется в качестве водородной бомбы и водородного ракетного двигателя. Также водород используется в качестве среды сопротивления при проведении некоторых физических и химических экспериментов.
Взаимодействие водорода с оксидом фосфора приводит к образованию воды, а также триоксида фосфора и предназначено для визуальной демонстрации в реакционных уроках.
- Водород + оксид фосфора = вода + триоксид фосфора
Водород играет важную роль в различных процессах и является основным элементом многих химических реакций. Его свойства делают его неотъемлемой частью многих областей науки и техники.
Аммиак

Такая реакция может протекать по следующему уравнению:
2NH3 + P2O5 → 2HPO3 + H2O.
В результате этой реакции образуется фосфорнокислая кислота (HPO3) и вода (H2O).
Аммиак широко используется в промышленности в качестве связующего средства, удобрения и сырья для производства различных химических соединений. Он обладает резким, настораживающим запахом и сильно раздражает слизистые оболочки дыхательных путей.
Обратите внимание на то, что лабораторная работа с аммиаком и оксидом фосфора должна проводиться в хорошо проветриваемом помещении или под вытяжным шкафом в целях обеспечения безопасности.
Органические соединения
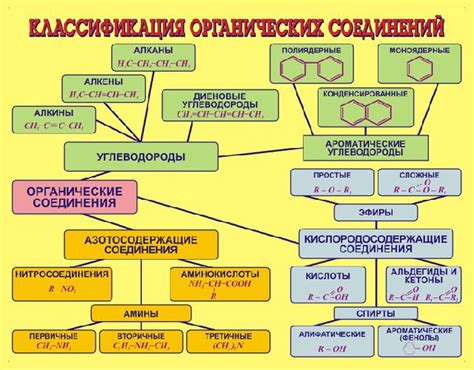
Некоторые известные органические соединения, которые могут реагировать с оксидом фосфора, включают:
- Алкены - двойные связи в молекулах алкенов могут реагировать с оксидом фосфора, образуя эфиры фосфорной кислоты.
- Амины - аминогруппа может реагировать с оксидом фосфора, образуя амиды фосфорной кислоты.
- Эфиры - гидроксильная группа эфиров может реагировать с оксидом фосфора, образуя ортоэфиры фосфорной кислоты.
- Карбоновые кислоты - карбоновые кислоты могут реагировать с оксидом фосфора, образуя анионы карбонила и продукты реакции.
Эти реакции с оксидом фосфора могут быть полезными в органическом синтезе, при синтезе новых соединений. Они могут приводить к образованию сложных органических соединений, имеющих различные свойства и применения в различных областях науки и промышленности.
Алкоголи

Одним из примеров алкоголов, реагирующих с оксидом фосфора, является метанол (CH3OH). В результате реакции с P4O10, метанол окисляется до формальдегида (CH2O), а затем до оксида углерода (CO2).
Другим примером алкоголей, реагирующих с оксидом фосфора, является этанол (C2H5OH). В результате реакции с P4O10, этанол окисляется до ацетальдегида (CH3CHO), а затем до уксусной кислоты (CH3CООН).
Таким образом, алкоголи могут реагировать с оксидом фосфора, претерпевая окисление и образуя различные продукты реакции.
Карбонаты

Один из примеров такой реакции - реакция между карбонатом натрия (Na2CO3) и оксидом фосфора (P2O5). В результате такой реакции образуется натрий-фосфат (Na3PO4) и диоксид углерода (CO2).
| Реакция: | ||
|---|---|---|
| Na2CO3 + P2O5 | → | Na3PO4 + CO2 |
Карбонаты широко используются в промышленности и в быту. Они могут использоваться в качестве отравителей кислоты, в процессе обработки и очистки воды, в производстве стекла и щелочи, а также в медицине.
Важно отметить, что реакции между карбонатами и оксидом фосфора являются пошаговыми и требуют определенных условий, таких как температура и давление, для их протекания.
Кислород

Кислород относится к активным элементам и проявляет химическую активность в реакциях с разными веществами. Он образует оксиды, включая один из наиболее распространенных – оксид фосфора (P2O5), также известный как фосфорный ангидрид.
Оксид фосфора вступает в реакцию с кислородом в присутствии катализаторов или при подогреве. Результатом этой реакции является образование фосфорной кислоты. Кроме того, оксид фосфора используется как дезгидратирующий агент и в других химических процессах.
Кислород также является важным элементом в медицине и используется для поддержания нормальной работы органов и тканей организма. Он применяется в качестве воздуха для дыхания, а также в медицинских аппаратах, таких как кислородные концентраторы и баллоны с кислородом.
Таким образом, кислород – важный химический элемент, образующий оксиды с разными веществами, в том числе с оксидом фосфора. Он играет важную роль в жизни организмов и находит применение в различных отраслях науки и промышленности.