Нагревание соли является одной из важных операций в химии. Когда соль подвергается воздействию тепла, происходят различные химические реакции, которые могут приводить к различным результатам. Знание этих процессов является ключевым для понимания многих аспектов химических реакций и их применений.
Во-первых, при нагревании солей происходит процесс дегидратации. Это означает, что часть или все молекулы воды, связанные с молекулами соли, выделяются в виде пара. Это особенно характерно для гидратированных солей, которые содержат в своей структуре молекулы воды. При нагревании эти соли обычно становятся более плотными и твердыми, так как удаляется влага.
Во-вторых, нагревание солей может приводить к термическому разложению. При этом соль распадается на два или более различных вещества, обычно при выделении газов или изменении окраски. Например, нагревание нитрата свинца приводит к образованию оксида свинца, которое имеет темно-красный цвет. Такие реакции имеют большое значение в различных процессах синтеза веществ и получения реактивов для различных химических реакций.
Таким образом, нагревание солей играет важную роль в химических реакциях и может приводить к различным результатам, включая дегидратацию и термическое разложение. Понимание этих процессов является фундаментальным для развития химической науки и применения ее в различных отраслях промышленности и научных исследований.
Общая информация о нагревании соли в химии
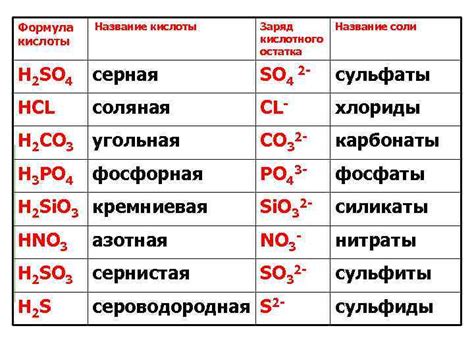
Суть нагревания соли заключается в изменении ее структуры и свойств, что может привести к различным химическим реакциям и физическим изменениям состояния вещества.
При нагревании некоторых солей происходит термическое разложение, когда соль распадается на простые вещества или окислитель и восстановитель. Такие реакции могут быть сопровождены выделением газа, изменением цвета или образованием остатка.
Нагревание солей может также привести к плавлению, когда твердая соль превращается в жидкое состояние под воздействием высокой температуры. Плавление солей может использоваться для получения различных соединений и для проведения химических реакций в расплавленной среде.
Кроме того, нагревание соли может изменить ее физические свойства, такие как растворимость или кристаллическая структура. Такие изменения могут иметь важное значение при проведении различных химических экспериментов и процессов.
Таким образом, нагревание соли в химии является важным процессом, который позволяет изменить свойства и состояние соли, открыть новые возможности для ее использования и проведения химических реакций.
Процесс выполнения эксперимента

Для выполнения эксперимента по нагреванию соли в химии следуйте инструкциям ниже:
- Выберите соль, которую вы хотите исследовать. Это может быть любой вид соли, такой как хлорид натрия (NaCl), сульфат меди (CuSO4), нитрат калия (KNO3) и др.
- Измерьте определенное количество соли, например, 5 граммов, и поместите ее в металлическую или керамическую посуду.
- Включите микроволновую печь или газовую плиту и подготовьте среду для нагревания соли.
- Осторожно разместите посуду с солью на плите или в микроволновке.
- Нагревайте соль, используя низкую или среднюю мощность, чтобы избежать ее перегрева или сгорания.
- Наблюдайте, что происходит с солью в процессе нагревания. Она может менять цвет, структуру или выделять газы.
- Запишите свои наблюдения и оцените результаты эксперимента.
Важно помнить, что при нагревании солей важно соблюдать меры предосторожности, такие как использование защитных очков и перчаток, чтобы избежать возможности получения ожогов или других травм.
Изменение внешнего вида соли при нагревании
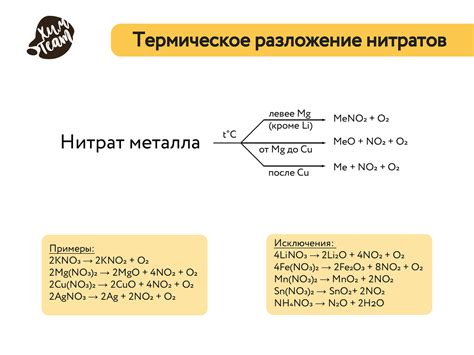
Например, при нагревании некоторых солей, таких как медный сульфат (CuSO4), происходит образование воды и оксида меди (CuO). В результате, соль меняет цвет с ярко-синего на черно-коричневый. Текстура соли также может измениться - она может стать более грубой или крошечной.
Такие изменения внешнего вида соли при нагревании являются результатом образования новых соединений или фаз, а также изменения их кристаллической структуры.
Изучение изменения внешнего вида соли при нагревании позволяет узнать о химических свойствах соли и процессах, которые происходят внутри нее при нагревании. Это важно для понимания механизмов химических реакций и применения солей в различных областях науки и промышленности.
Химические реакции, происходящие при нагревании соли

Одной из основных реакций, происходящих при нагревании соли, является диссоциация. При нагревании соль распадается на ионы, которые могут двигаться свободно. Диссоциация позволяет соли мгновенно растворяться в воде и повышает их реакционную активность.
Другой реакцией, которая может происходить при нагревании соли, является дегидратация. Некоторые соли имеют в своем составе молекулы воды, которые могут быть удалены при нагревании. Это делается путем испарения молекул воды, что приводит к уменьшению массы соли.
Термическое разложение – это еще один тип реакции, происходящей при нагревании солей. При этом процессе соль разлагается на более простые соединения или элементы. Это может произойти, например, когда соль содержит кислород или другие элементы, которые могут быть отделены при нагревании.
Также при нагревании соли может происходить окисление или восстановление, что ведет к изменению степени окисления элементов в соединении. Эти реакции могут привести к образованию новых соединений или изменению цвета соли.
Все эти реакции происходят при разных температурах и зависят от состава соли и условий нагревания. Изучение этих реакций позволяет лучше понять химические свойства солей и использовать их в различных отраслях науки и промышленности.
Выделение газов при нагревании соли

При нагревании солей происходят различные химические реакции, в результате которых могут выделяться газы.
Выделение газов при нагревании соли обусловлено разложением соединений, содержащихся в соли. Это происходит из-за высокой температуры, которая способна отделить от соли другие компоненты в виде газообразных продуктов.
Чаще всего при нагревании солей выделяются следующие газы:
| Соль | Газ |
|---|---|
| Карбонаты металлов | Углекислый газ (CO2) |
| Хлориды металлов | Хлор (Cl2) |
| Нитраты металлов | Кислород (O2) |
| Сульфаты металлов | Серный газ (SO2) |
Выделение газов при нагревании солей является важным явлением в химии, так как позволяет определить состав и свойства соли. Также выделение газов при нагревании соли может применяться в лабораторных экспериментах для получения и изучения газовых веществ.
Образование остатка при нагревании соли

Образование остатка при нагревании соли зависит от ее состава и химических свойств. Некоторые соли разлагаются полностью, оставляя только чистые элементы или соединения. Другие соли могут образовывать сложные окислительно-восстановительные реакции или реакции перехода с составной солью на простую.
Одним из наиболее распространенных примеров образования остатка при нагревании соли является разложение карбоната кальция (CaCO3). При нагревании карбоната кальция до высоких температур он разлагается на оксид кальция (CaO) и углекислый газ (CO2). Углекислый газ выбирается, а оксид кальция остается в виде остатка.
Остатки, образующиеся при нагревании солей, могут иметь разнообразные физические и химические свойства. В зависимости от условий нагревания и состава соли, остатки могут быть твердыми, жидкими или газообразными. Они также могут быть стойкими или нетоксичными, что важно учитывать при обработке и утилизации остатков.
Образование остатка при нагревании соли является основным процессом во многих химических реакциях. Изучение этого процесса позволяет лучше понять химические свойства и реакционную способность солей, а также применять их в различных областях, включая промышленность, медицину и сельское хозяйство.
Роль нагревания соли в производстве различных продуктов

Одним из примеров такого процесса является получение щелочей. Натриевая соль поваренной соли (NaCl) нагревается в особых условиях, и в результате получают щелочи, такие как гидроксид натрия (NaOH). Гидроксид натрия широко используется в производстве мыла, стекла, отбеливателей и других продуктов.
В процессе нагревания соли можно также получить различные химические соединения, такие как нитраты и сульфаты. Например, нагревание нитрата меди (Cu(NO3)2) приводит к образованию оксида меди (CuO) и выделению кислорода. Оксид меди используется в производстве электроники, эмалей, керамики и других материалов.
Нагревание соли также применяется при производстве пищевых продуктов. Например, при нагревании некоторых солей, таких как хлорид кальция (CaCl2), происходит образование кальция и выделение хлорида. В результате получаются продукты с добавлением кальция, которые используются для укрепления зубов и костей.
- Нагревание соли играет важную роль в производстве щелочей
- Позволяет получить различные химические соединения
- Применяется при производстве пищевых продуктов



