Кипение – это процесс, при котором вода превращается из жидкого состояния в газообразное при достижении определенной температуры. Но что происходит с молекулами воды во время этого физического процесса?
Молекулы воды – это комбинация атомов водорода и кислорода, соединенных ковалентными связями. В нормальных условиях, они двигаются и вибрируют вокруг своего положения равновесия.
Однако, когда вода нагревается, молекулы начинают двигаться более активно и вибрировать с большей амплитудой. Когда температура достигает точки кипения, энергия, полученная молекулами, становится настолько высокой, что они переходят в газообразное состояние.
Кипение воды: что происходит с молекулами?
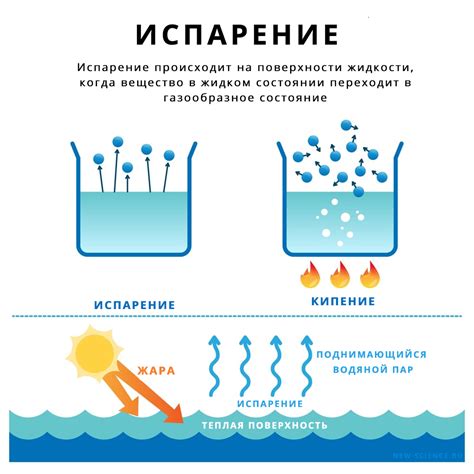
Когда вода нагревается, ее молекулы приобретают энергию, которая заставляет их двигаться быстрее. При достижении определенной температуры, называемой температурой кипения, энергии достаточно, чтобы молекулы воды преодолели притяжение друг друга и вышли в паровую фазу.
В процессе кипения молекулы воды начинают переходить из жидкой фазы в газообразную фазу. Кипение происходит на поверхности жидкости, где молекулы воды получают достаточно энергии, чтобы перейти в паровую фазу.
Когда вода кипит, молекулы воды перемещаются в хаотичном порядке, сталкиваясь друг с другом и отскакивая в разные направления. Это создает пузырьки пара, которые видны на поверхности воды во время кипения.
Один из ключевых факторов, влияющих на процесс кипения, - это атмосферное давление. При снижении давления на поверхность воды, ее температура кипения также снижается. Например, на высоких горных вершинах, где атмосферное давление ниже, вода начинает кипеть уже при более низкой температуре.
Важно отметить, что при кипении вся масса воды преобразуется в пар, но при этом не происходит разрушение структуры молекул воды. После охлаждения пара обратно в жидкую фазу, молекулы воды возвращаются к своему обычному положению и взаимодействуют друг с другом на молекулярном уровне.
| Процесс кипения: | Процесс конденсации: |
|---|---|
| Молекулы воды получают энергию и двигаются быстрее. | Молекулы водяного пара теряют энергию и замедляются. |
| Молекулы воды преодолевают притяжение друг друга и переходят в паровую фазу. | Молекулы водяного пара рассеиваются и становятся жидкими. |
| Создание пузырьков пара на поверхности воды. | Создание капель жидкости из пара. |
| Нагрев материала. | Охлаждение материала. |
Фазовые переходы вещества
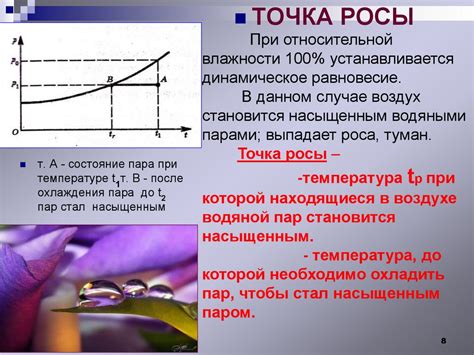
Находясь в паровой фазе, молекулы воды свободно двигаются и более разрежены. Они сталкиваются между собой и со стенками сосуда, в котором находится вода, создавая давление. При достижении точки кипения воды, давление пара равно или превышает атмосферное давление. Это приводит к образованию пузырьков пара, которые всплывают на поверхность и вызывают кипение.
При охлаждении водяных паров их энергия уменьшается, и молекулы начинают сближаться и образовывать водяные капли. На определенной температуре, называемой точкой росы, образовавшиеся капли конденсируются на поверхности объектов, создавая конденсацию. На этом этапе происходит обратный фазовый переход – пары воды превращаются в жидкую фазу.
Понятие кипения

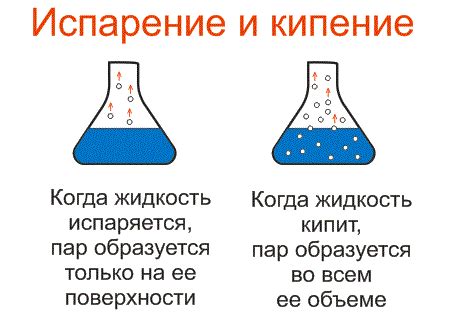
В процессе кипения молекулы воды получают достаточно энергии, чтобы преодолеть притяжение друг к другу и перейти в газообразное состояние. Молекулы воды обладают кинетической энергией, которая варьирует в зависимости от температуры.
При достижении точки кипения, количество пара, образующегося на поверхности жидкости, становится равным количеству пара, который конденсируется назад в жидкую фазу. Кипение происходит на всей протяженности жидкости и приводит к образованию пузырьков пара, которые взрываются на поверхности и выбрасываются в окружающую среду.
Кипение воды является важным процессом, который широко используется в промышленности и в повседневной жизни. Этот процесс уничтожает бактерии и другие микроорганизмы, делая воду безопасной для питья. Кипячение также используется при приготовлении пищи и в процессе стерилизации.
Энергия и кипение воды
Основным фактором, влияющим на кипение воды, является энергия. Теплоэнергия, подводимая к воде, позволяет молекулам воды покинуть жидкое состояние и перейти в состояние пара. Энергия, необходимая для перехода молекул воды в газообразное состояние, называется энергией парообразования.
В процессе кипения, молекулы воды получают достаточно энергии, чтобы преодолеть силы притяжения между ними и разлететься в разных направлениях. Это приводит к образованию пузырьков пара, которые видны на поверхности кипящей воды.
Температура, при которой начинается кипение воды, зависит от давления окружающей среды. При нормальном атмосферном давлении, точка кипения воды составляет 100 градусов Цельсия. При повышенных давлениях, например, в закрытом сосуде, точка кипения может быть выше.
Кипение воды является важным физическим процессом, который используется во многих сферах деятельности человека. Кипяток используется для приготовления пищи, стерилизации, убийства бактерий и многих других целей.
Изменения молекулярной структуры воды
Когда вода нагревается до точки кипения, происходит ряд интересных изменений в ее молекулярной структуре.
В обычных условиях водная молекула состоит из двух атомов водорода и одного атома кислорода, связанных с помощью ковалентных связей. Эти связи обладают полярностью, что делает воду поларной молекулой.
Однако, при нагревании воды до точки кипения, молекулы начинают двигаться более активно, и их кинетическая энергия увеличивается. Это приводит к настолько интенсивному движению молекул, что они начинают ломать свои ковалентные связи между атомами водорода и кислорода.
По мере нагревания, все больше и больше молекул теряют свои ковалентные связи и становятся свободными. В результате этого, вода переходит из жидкого состояния в газообразное состояние.
Таким образом, при кипении воды происходят изменения в ее молекулярной структуре. Вместо связей между молекулами, образуются слабые межмолекулярные силы притяжения, что позволяет молекулам воды перемещаться свободно в паровой фазе.
Изменения молекулярной структуры воды при кипении объясняют, почему паровое состояние воды очень различается от ее жидкого состояния. В паровой фазе молекулы воды разделены и двигаются по отдельности, в то время как в жидкой фазе они близко связаны друг с другом.
Влияние температуры на движение молекул
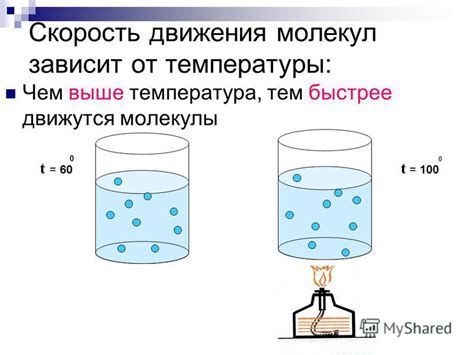
Когда вода нагревается до точки кипения, ее температура достигает значения 100 градусов Цельсия. При этой температуре молекулы воды получают достаточно энергии, чтобы преодолеть силы притяжения между ними и перейти в газообразное состояние.
На молекулярном уровне это происходит следующим образом: при нагревании вода поглощает энергию из внешней среды. Энергия тепла передается молекулам, что приводит к их возрастанию внутренней энергии. Молекулы, обладая большей энергией, часто сталкиваются друг с другом и совершают быстрые и хаотичные движения.
Когда вода нагревается до кипения, некоторые молекулы обретают и достаточно энергии, чтобы преодолеть силы притяжения других молекул и перейти в паровую фазу. Однако не все молекулы воды достигают этой энергии сразу, поэтому процесс кипения продолжается до тех пор, пока все молекулы не будут достаточно нагреты для перехода в газообразное состояние.
Таким образом, температура играет решающую роль в движении молекул вещества. Повышение температуры увеличивает их скорость и энергию, что может приводить к смене фазы вещества, такой как переход из жидкого состояния в газообразное состояние при кипении воды.
Образование пузырей при кипении
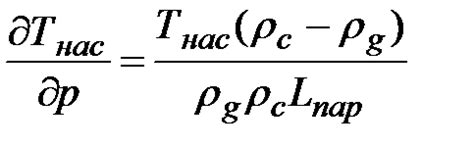
Образование пузырьков происходит из-за того, что газообразное состояние воды занимает больше места, чем жидкое состояние. Поэтому при нагревании, молекулы воды вырываются из жидкости и образуют пузырьки газа. Эти пузырьки намного легче, чем окружающая среда, поэтому они начинают всплывать вверх. Когда пузырь переходит через поверхность, он лопается, отделяясь от остальной жидкости.
Этот процесс образования и всплытия пузырей продолжается до тех пор, пока жидкость находится в состоянии кипения. При этом, чем сильнее нагревается вода, тем больше пузырьков образуется и чаще они всплывают на поверхность.
Образование пузырей при кипении воды является часто наблюдаемым и важным явлением. Оно помогает охлаждать и перемешивать жидкость, а также ускорять процессы химических реакций. Поэтому понимание этого процесса имеет большое практическое значение для различных научных и технических областей.
 |  |
Влияние внешних факторов на кипение воды
| Внешний фактор | Влияние на кипение воды |
|---|---|
| Давление | Увеличение давления на воду приводит к повышению ее кипящей температуры. Например, в герметичных условиях на больших глубинах морей вода может кипеть даже при более высоких температурах. |
| Примеси | Наличие примесей в воде может снижать ее кипящую температуру. Например, добавление соли в воду приводит к снижению ее температуры кипения. |
| Наличие нуклеационных центров | Нуклеационные центры, такие как микроскопические частицы или неровности поверхности, могут способствовать образованию пузырьков пара и ускорять процесс кипения воды. |
| Тип и состояние сосуда | Выбор материала сосуда и его состояние (чистота, гладкость поверхности) также могут влиять на процесс кипения воды. Сосуды из материалов с хорошей теплопроводностью, таких как медь или алюминий, могут более эффективно передавать тепло воде и ускорять кипение. |
Все эти факторы имеют влияние на кипение воды и могут быть учтены при подборе оптимальных условий для различных процессов, требующих использования кипящей воды.
Зависимость кипения воды от атмосферного давления
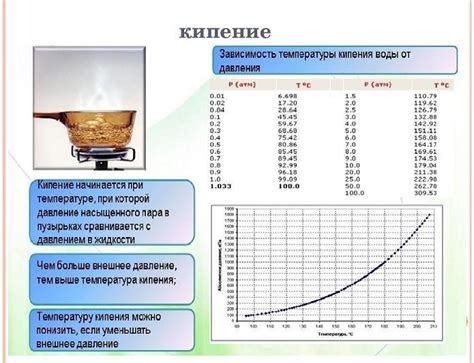
Чем выше атмосферное давление, тем выше должна быть температура, для того чтобы вода начала кипеть. При нормальных условиях, при давлении 1 атмосферы, вода кипит при температуре 100 градусов Цельсия.
При повышении атмосферного давления точка кипения воды также повышается. Например, при давлении 2 атмосферы, температура кипения воды составит уже около 120 градусов Цельсия.
С другой стороны, при снижении атмосферного давления, точка кипения воды снижается. На больших высотах, где атмосферное давление ниже, вода может кипеть уже при температуре ниже 100 градусов Цельсия.
Это связано с тем, что при повышении давления, молекулы воды имеют большую энергию, поэтому им требуется больше энергии для перехода в паровую фазу.
- При снижении давления, молекулы воды разом расширяются и начинают быстрее двигаться, что приводит к более быстрому кипению.
- При повышении давления, молекулы воды сжимаются и движутся медленнее, что затрудняет переход в паровую фазу.
Таким образом, давление оказывает прямое влияние на температуру кипения воды. Это явление является фундаментальным и имеет важное значение в различных процессах, связанных с поварением и готовкой пищи, а также в научных и промышленных экспериментах.