Состояние электрона – одно из основных понятий атомной физики, определяющее поведение электронов в атоме. Электрон, взаимодействуя с атомным ядром, находится в определенном состоянии, которое характеризуется своей энергией, орбитальным моментом и спином.
Каждый электрон в атоме может занимать определенные энергетические уровни, называемые орбиталями. Орбитали представляют собой пространственные области вокруг атомного ядра, в которых электрон может находиться с определенной вероятностью. Они различаются по форме, размеру и ориентации в пространстве.
Кроме энергетических уровней, электрону свойственны орбитальный момент и спин. Орбитальный момент определяет момент импульса электрона, его вращение вокруг атомного ядра. Спин – внутреннее свойство электрона, обусловленное его вращением вокруг своей оси.
Изучение состояния электрона в атоме позволяет понять многое о свойствах атомов и молекул, а также является основой для разработки квантовой теории и многочисленных приложений в физике, химии и технологии.
Состояние электрона в атоме: ключевые аспекты
Основными аспектами состояния электрона являются его энергия, орбиталь и спин. Это параметры, которые полностью определяют состояние электрона и его поведение.
Энергия электрона в атоме является квантовой и дискретной величиной. Электроны в атоме могут находиться только на определенных энергетических уровнях. Каждый уровень имеет свою нумерацию и соответствует определенной энергии электрона.
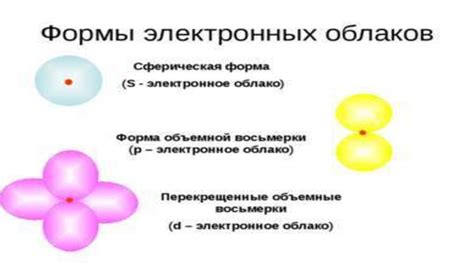
Орбиталь - это пространственная область вокруг ядра атома, в которой находится электрон. Орбитали обозначаются буквами s, p, d, f и могут иметь различную форму и размеры. Каждая орбиталь может содержать до двух электронов с противоположными спинами.
Спин - это внутреннее свойство электрона, которое определяет его магнитный момент. Спин может быть ориентирован вверх или вниз, что соответствует значениям +1/2 и -1/2. Электроны с противоположными спинами обладают противоположными магнитными моментами.
Комбинация энергии, орбитали и спина определяет состояние электрона в атоме. Электроны заполняют атомные орбитали на основе принципа запрета Паули, который гласит, что в одной орбитали может находиться максимум два электрона с противоположным спином.
Понимание состояния электрона в атоме имеет большое значение для объяснения спектральных линий, химической связи и других физических явлений, связанных с атомами и молекулами. Квантовая механика позволяет описать состояние электрона с высокой точностью и предсказать его поведение в атоме.
Расположение электрона в атоме

Электрон, как элементарная частица, обладает свойствами частицы и волны. Его расположение в атоме можно описать с помощью квантовых состояний. Каждое состояние характеризуется определенными значениями энергии, момента и магнитного момента электрона.
Согласно принципу неопределенности Гейзенберга, точное измерение одновременно координаты и импульса электрона невозможно. Вместо того, чтобы говорить о точном положении электрона, мы говорим о его вероятностном распределении вокруг ядра атома.
Орбитали – это области вероятности нахождения электрона в атоме. Каждая орбиталь характеризуется своими квантовыми числами – главным, орбитальным и магнитным, влияющими на распределение электронов вокруг ядра. Число орбиталей зависит от главного квантового числа и может быть выражено формулой 2n^2, где n – главное квантовое число.
Существует несколько типов орбиталей: s, p, d, f. Орбитали s находятся ближе к ядру и имеют форму сферы, орбитали p – форму шара с вытянутой осью, орбитали d – сложную форму с дополнительными петлями и орбитали f – очень сложную форму.
Каждая орбиталь может содержать до двух электронов с одинаковыми квантовыми числами, но противоположными спинами. Электроны заполняют орбитали в соответствии с принципом заполнения, который утверждает, что они заполняют орбитали низкой энергии передвигаясь к орбиталям более высокой энергии.
Важно отметить, что состояние электрона в атоме не является постоянным и может изменяться в результате взаимодействия с другими атомами или внешними факторами.
Уровни энергии электрона

Состояние электрона в атоме определяется его энергией. Энергия электрона может принимать только определенное значение, которое соответствует определенному уровню энергии.
Уровни энергии электрона в атоме называются также энергетическими уровнями. Каждый энергетический уровень имеет свою определенную энергию, которая характеризует электрон на этом уровне.
Уровни энергии электрона образуют лестничную структуру, где каждый следующий уровень находится на большей высоте энергии по сравнению с предыдущим. Самый ближайший уровень к ядру атома имеет наименьшую энергию, а самый удаленный уровень - наибольшую.
Электрон может занимать только те уровни энергии, которые предоставляются веществом, в котором он находится. На каждом уровне энергии может находиться ограниченное количество электронов, определяемое квантовыми правилами.
Уровни энергии электрона в атоме позволяют объяснить такие явления, как атомная спектроскопия и возникающие в процессе переходов электронов между энергетическими уровнями электромагнитные излучения. Понимание уровней энергии электрона также лежит в основе понимания химической связи и других фундаментальных процессов, происходящих в атомах и молекулах.
Квантовое число и состояние электрона
Квантовое число играет важную роль в определении состояния электрона в атоме. Квантовые числа помогают определить энергетический уровень, форму орбитали и ориентацию пространственного положения электрона.
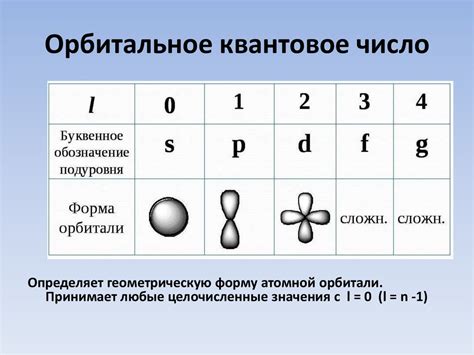
Основные квантовые числа это главное (n), орбитальное (l), магнитное (m) и спиновое (s) квантовые числа. Главное квантовое число (n) определяет энергетический уровень электрона и может принимать значения от 1 и выше. Чем больше значение главного квантового числа, тем выше энергетический уровень электрона.
Орбитальное квантовое число (l) определяет форму орбитали, в которой находится электрон. Оно может принимать значения от 0 до n-1, где n - значение главного квантового числа. Например, для электрона на первом энергетическом уровне (n=1), значение орбитального квантового числа будет равно 0.
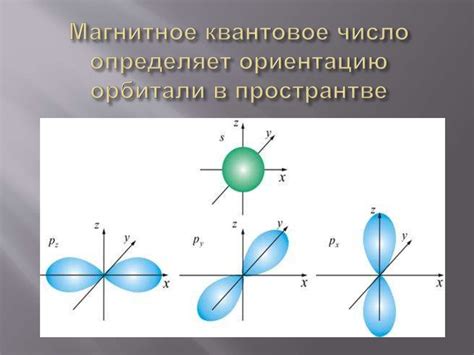
Магнитное квантовое число (m) определяет ориентацию пространственного положения орбитали. Оно может принимать значения от -l до +l. Например, для электрона на первой орбитали (l=0), значение магнитного квантового числа будет равно 0.
Спиновое квантовое число (s) определяет направление вращения электрона вокруг своей оси. Оно может принимать значения ±1/2, где положительное значение соответствует вращению по часовой стрелке, а отрицательное - против часовой стрелки.
Комбинация всех этих квантовых чисел позволяет полностью описать состояние электрона в атоме. Состояние электрона определяется также через набор квантовых чисел определенными правилами -- принципом заполнения электронных оболочек и правилом Хунда.
Орбитали и магнитные квантовые числа
Магнитные квантовые числа обозначают энергию и ориентацию орбитали. Они характеризуются следующими значениями:
- Основное магнитное квантовое число (l) - определяет форму орбитали. Оно может принимать значения от 0 до n-1, где n - главное квантовое число (определяет энергию уровня электрона).
- Магнитное квантовое число (ml) - определяет ориентацию орбитали в пространстве. Оно может принимать значения от -l до l.
Например, если главное квантовое число n=2, то для этого энергетического уровня могут существовать четыре орбитали:
- Орбиталь s (l=0, ml=0) - имеет сферическую форму и находится в центре атома.
- Орбиталь p (l=1, ml=-1,0,1) - имеет форму двояковосьмой и может располагаться в трех ортогональных направлениях.
- Орбиталь d (l=2, ml=-2,-1,0,1,2) - имеет форму двояковосьмой и может располагаться в пяти ортогональных направлениях.
- Орбиталь f (l=3, ml=-3,-2,-1,0,1,2,3) - имеет сложную форму и может располагаться в семи ортогональных направлениях.
Таким образом, магнитные квантовые числа определяют структуру и распределение электронов в атоме, что в свою очередь влияет на его химические свойства и реактивность.
Спин электрона и его состояние

Состояние спина электрона можно описать с помощью квантовых чисел спина. Квантовые числа спина имеют два возможных значения: "спин вверх" и "спин вниз". Спин электрона может находиться в одном из двух состояний – "вверх" или "вниз".
Состояние спина электрона имеет важное значение для определения его энергии и магнитного поведения в атоме. Кроме того, спин электрона играет ключевую роль в процессах обмена энергией и взаимодействия с магнитным полем.
Спин электрона имеет большое значение в физике атома и квантовой механике, так как состояние спина электрона определяет структуру электронных оболочек атома и связанные с этим химические свойства элементов.
Таким образом, спин электрона и его состояние являются важными аспектами физики атома и имеют глубокое влияние на различные явления и свойства в микромире.
Квантовая механика и состояние электрона

Квантовая механика, как фундаментальная теория микромира, описывает поведение частиц на микроскопическом уровне, включая состояние электронов в атоме. Согласно квантовой механике, электрон в атоме может существовать только в определенных энергетических состояниях, которые называются квантовыми состояниями.
Квантовые состояния электрона определяются его волновой функцией, которая описывает вероятность обнаружения электрона в различных точках пространства. Волновая функция электрона зависит от набора квантовых чисел, таких как главное квантовое число, орбитальное квантовое число и магнитное квантовое число.
Квантовая механика предсказывает, что электрон может иметь определенные энергии, называемые уровнями энергии. Каждый уровень энергии имеет свою волновую функцию и набор квантовых чисел. На каждом уровне электрон может находиться в разных орбиталях, имеющих свой форму и ориентацию в пространстве.
Квантовая механика также устанавливает ограничения на количество электронов, которые могут находиться на каждом уровне энергии и в каждой орбитали. Известно, что внутренняя оболочка атома может содержать не более 2 электронов, а внешняя оболочка может содержать до 8 электронов.
| Квантовое число | Значение | Описание |
|---|---|---|
| Главное квантовое число | n | Определяет энергию и размер орбитали. Может принимать целочисленные значения ≥ 1. |
| Орбитальное квантовое число | l | Определяет форму орбитали. Может принимать значения от 0 до n-1. |
| Магнитное квантовое число | ml | Определяет ориентацию орбитали в пространстве. Может принимать значения от -l до l. |
Таким образом, состояние электрона в атоме определяется набором квантовых чисел, которые определяют его энергию, орбиталь и ориентацию в пространстве. Понимание состояния электрона является ключевым аспектом в квантовой механике и помогает объяснить многочисленные явления, связанные с поведением атомов и молекул.
Скорость и импульс электрона в состоянии атома

Движение электронов в атоме описывается квантовой механикой и основано на понятии энергетических уровней. Каждый энергетический уровень характеризуется определенной энергией и квантовыми числами, такими как главное квантовое число (n), орбитальное квантовое число (l) и магнитное квантовое число (m).
На каждом энергетическом уровне могут находиться один или несколько электронов. Электроны находятся на уровне внутренними или валентными. Валентные электроны находятся на более высоких энергетических уровнях и определяют химические свойства атома.
Скорость электрона на определенном энергетическом уровне может быть рассчитана с использованием теории де Бройля. Согласно этой теории, каждая частица, включая электрон, обладает волновыми свойствами. Де Бройль предложил следующую формулу для вычисления де Бройля длины волны электрона:
- λ = h / p
где λ - де Бройля длина волны электрона, h - постоянная Планка, p - импульс электрона.
Данная формула позволяет связать длину волны электрона с его импульсом. Таким образом, имея информацию о де Бройль длинах волн электронов на различных энергетических уровнях, можно определить их скорость.
Импульс электрона можно рассчитать по следующей формуле:
- p = m * v
где p - импульс электрона, m - его масса, v - его скорость.
Таким образом, зная массу электрона и его скорость, можно рассчитать его импульс в состоянии атома. Учитывая связь между импульсом и энергией (p = √(2mE)), можно также определить кинетическую энергию электрона.
Имея информацию о скорости и импульсе электрона в состоянии атома, можно более полно описать его движение, взаимодействие с другими электронами и его роль в химических реакциях.