Степень электролитической диссоциации – это важный параметр, используемый в химии для описания процесса диссоциации электролитов в растворах. Под диссоциацией понимается процесс, при котором молекулы электролита разделяются на ионы, обычно положительно и отрицательно заряженные.
Степень электролитической диссоциации обозначает, какая часть электролита диссоциировала в растворе. Обычно она выражается в процентах или десятичных долях от 0 до 1. Таким образом, степень диссоциации позволяет определить, насколько эффективно электролит разделяется на ионы в растворе.
Степень диссоциации зависит от различных факторов, таких как концентрация электролита, температура, свойства растворителя и раствора, а также наличие других веществ в растворе. Величина степени диссоциации может быть разной для различных электролитов и в разных условиях.
Изучение степени электролитической диссоциации позволяет лучше понять свойства растворов и прогнозировать химические реакции, которые могут происходить в них. Как и все параметры химических процессов, степень диссоциации требует внимания и тщательных экспериментальных измерений для достоверной оценки.
Краткое описание и определение

Когда степень электролитической диссоциации равна 100%, это означает, что все молекулы электролита в растворе распались на ионы. Когда степень диссоциации меньше 100%, только часть молекул электролита распалась на ионы, а остальные остаются в недиссоциированном виде.
Степень электролитической диссоциации зависит от различных факторов, таких как концентрация электролита в растворе, температура и химические свойства самого электролита. Высокая степень электролитической диссоциации является характеристикой сильного электролита, тогда как низкая степень указывает на слабый электролит.
Роль степени электролитической диссоциации в химических реакциях
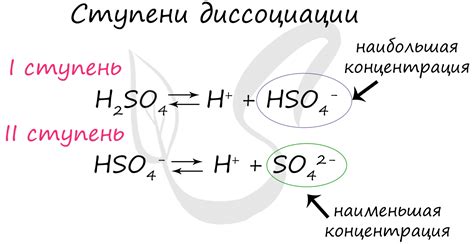
Степень электролитической диссоциации может быть выражена в виде числа от 0 до 1 или в процентах от 0% до 100%. Если степень диссоциации равна 0 или близка к нулю, это означает, что электролит плохо или вовсе не диссоциировал на ионы. Если степень диссоциации равна 1 или близка к единице, это говорит о полной или почти полной диссоциации электролита.
Степень электролитической диссоциации имеет важное значение для понимания химических реакций. Электролитическая диссоциация играет роль в концентрации ионов в растворе, что влияет на скорость реакции и образование продуктов. Более диссоциированные электролиты могут образовывать более активные ионы, которые легче участвуют в реакциях с другими веществами.
Кроме того, степень электролитической диссоциации может влиять на равновесие химической реакции. Если электролит диссоциирует полностью, то его концентрация в реакции значительно увеличивается и этот электролит может являться сильным фактором, влияющим на равновесие.
Понимание степени электролитической диссоциации является важным аспектом химии, который помогает установить связь между химическими веществами, их растворимостью и реакционной активностью. Изучение этого понятия позволяет более глубоко понять и объяснить основные законы химии и может быть использовано для прогнозирования химических реакций и их условий.
Влияние факторов на степень электролитической диссоциации

Степень электролитической диссоциации зависит от ряда факторов:
1. Концентрация электролита: Чем выше концентрация, тем больше возможностей для электролита распасться на ионы, поэтому степень диссоциации будет выше.
2. Температура раствора: При повышении температуры, скорость диссоциации электролита увеличивается, что влечет за собой увеличение степени электролитической диссоциации.
3. Полярность растворителя: Вещества с полярными связями лучше диссоциируются в полярных растворителях, поэтому степень диссоциации таких электролитов будет выше.
4. Размер заряда иона: Маленькие ионы диссоциируются лучше, чем большие, поэтому электролиты с ионами маленького размера обычно имеют более высокую степень электролитической диссоциации.
5. Взаимодействие ионов: Взаимодействие соседних ионов в растворе может способствовать снижению степени диссоциации. Например, межионные ассоциации или солевые комплексы могут связывать часть ионов.
Влияние этих факторов на степень электролитической диссоциации позволяет понять, как изменение условий может повлиять на процессы диссоциации в растворах, что имеет важное значение для понимания химических реакций и физических свойств веществ.
Как измерить степень электролитической диссоциации
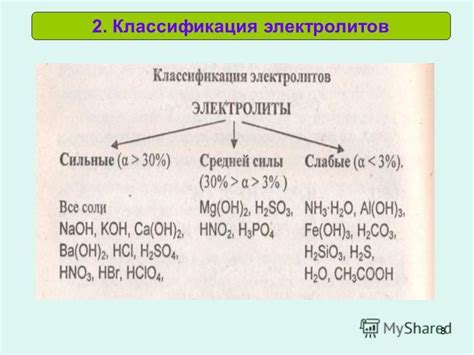
Существуют различные методы измерения степени электролитической диссоциации, некоторые из которых представлены ниже:
1. Метод проводимости: Этот метод основан на изменении проводимости раствора при увеличении степени диссоциации. Проводимость раствора содержит информацию о количестве ионов, которые могут перемещаться в растворе. Измеряя проводимость раствора с разными концентрациями, можно определить степень электролитической диссоциации.
2. Метод электролиза: Этот метод основан на использовании электрического тока для разложения электролита на ионы. При известной концентрации электролита и измерении количества продуктов электролиза, можно определить степень диссоциации.
3. Метод способности ионов к осаждению: Этот метод основан на наблюдении осаждения ионов из раствора. Если численная концентрация осадка будет известна, можно определить степень электролитической диссоциации.
4. Метод расчета: Этот метод основан на анализе химических уравнений и известных данных о реакции. Используя стехиометрию и вычислительные методы, можно рассчитать степень электролитической диссоциации.
Выбор метода измерения степени электролитической диссоциации зависит от характера и свойств реакции, доступных инструментов и требуемой точности результата. Эти методы позволяют определить степень диссоциации электролита и помочь исследователям и студентам получить более полное представление о химическом взаимодействии в растворах.
Примеры степеней электролитической диссоциации различных веществ
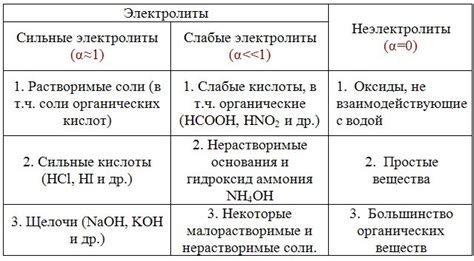
Пример 1: Соляная кислота (HCl)
Вещество HCl диссоциирует полностью в растворе, образуя равное количество ионов Cl- и H+. В таком случае, степень электролитической диссоциации будет равна 1.
Пример 2: Уксусная кислота (CH3COOH)
Уксусная кислота диссоциирует частично в растворе, образуя ионы CH3COO- и H+. В результате, степень электролитической диссоциации уксусной кислоты будет меньше 1, например, около 0,4.
Пример 3: Аммиак (NH3)
Вещество NH3 не является электролитом в чистом виде, но в растворе оно диссоциирует, образуя ионы NH4+ и OH-. Однако, диссоциация амиака происходит в очень ограниченном количестве, поэтому его степень электролитической диссоциации будет очень маленькой, например, около 0,01.
Это лишь некоторые примеры степеней электролитической диссоциации различных веществ. Знание степени диссоциации помогает понять, как сильно вещество будет проводить электрический ток в растворе, что имеет важные значения в химических процессах и реакциях.
Практическое применение степени электролитической диссоциации
1. Расчет концентрации ионов
Зная степень диссоциации, можно определить концентрацию ионов в растворе. Это особенно важно при проведении химических анализов и в лабораторной практике.
2. Расчет pH-значения раствора
Степень электролитической диссоциации является ключевым фактором в расчете pH-значения раствора. Она влияет на концентрацию ионов в растворе, что, в свою очередь, определяет кислотность или щелочность раствора.
3. Определение электропроводности раствора
Степень диссоциации также определяет электропроводность раствора. Чем выше степень диссоциации, тем сильнее она будет проводить электрический ток. Это имеет практическое значение при проектировании электролитических элементов, батарей и других электрохимических систем.
4. Управление химическими реакциями
Степень электролитической диссоциации может служить индикатором для определения направления и скорости химических реакций. Например, зная степень диссоциации электролита, можно предсказать, как быстро протекнет реакция и какие продукты образуются.
В целом, понимание и применение степени электролитической диссоциации позволяет проводить более точные расчеты растворов, предсказывать химические реакции и управлять процессами в химической промышленности и лаборатории. Это открывает новые возможности для разработки новых материалов, улучшения процессов экстракции и производства, а также для решения задач в области физической и аналитической химии.