Тепловой эффект при постоянном объеме является важной характеристикой химических реакций и может быть рассчитан с использованием определенной формулы. Этот параметр позволяет определить количество тепла, которое выделяется или поглощается в результате химической реакции, когда объем системы остается постоянным.
Формула для расчета теплового эффекта при постоянном объеме выражается следующим образом:
qV = CV * ∆T
Где:
- qV - тепловой эффект при постоянном объеме
- CV - теплоемкость при постоянном объеме
- ∆T - изменение температуры системы
Таким образом, для расчета теплового эффекта при постоянном объеме необходимо знать теплоемкость при постоянном объеме и изменение температуры системы.
Пример использования формулы: предположим, что имеется химическая реакция, в результате которой происходит выделение тепла. Теплоемкость при постоянном объеме системы составляет 50 Дж/К, а изменение температуры равно 10 К. Подставив значения в формулу, получим:
qV = 50 Дж/К * 10 К = 500 Дж
Таким образом, тепловой эффект при постоянном объеме в данном примере составляет 500 Дж.
Тепловой эффект при постоянном объеме

Для расчета теплового эффекта при постоянном объеме используется формула:
- Q = Cv * ΔT
Где:
- Q - тепловой эффект
- Cv - молярная теплоемкость при постоянном объеме
- ΔT - изменение температуры
Применение формулы позволяет определить количество тепла, выделенного или поглощенного в химической реакции, когда объем системы остается постоянным. Это особенно важно при проведении экспериментов в лабораторных условиях, где объем реакционной смеси не может изменяться.
Например, при сгорании 1 моля газа при постоянном объеме исходная температура может быть 300 К, а конечная температура - 400 К. Молярная теплоемкость при постоянном объеме равна 20 Дж/К*моль. Расчет теплового эффекта будет следующим:
- Q = 20 Дж/К*моль * (400 К - 300 К) = 200 Дж
Таким образом, при сгорании 1 моля газа при постоянном объеме выделяется 200 Дж тепла.
Знание теплового эффекта при постоянном объеме позволяет более точно планировать и контролировать химические реакции, а также оценивать энергетические потребности и возможности различных процессов.
Формула расчета теплового эффекта

| ΔH = q |
где ΔH - тепловой эффект (в кДж или Дж), q - количество тепла (в кДж или Дж), поглощаемое или выделяемое при реакции.
Для определения знака теплового эффекта используется закон сохранения энергии. Если при реакции поглощается тепло, то тепловой эффект считается положительным (+ΔH). Если при реакции выделяется тепло, то тепловой эффект считается отрицательным (-ΔH).
Рассмотрим пример расчета теплового эффекта. Рассмотрим реакцию горения метана:
CH4 + 2O2 -> CO2 + 2H2O
Для определения теплового эффекта этой реакции необходимо знать количество тепла, поглощаемое или выделяемое при образовании одного моля реакционных веществ. Если известны энтальпии образования веществ, то тепловой эффект можно рассчитать по следующей формуле:
| ΔH = ∑νfΔHf |
где ν - количество молей соответствующего вещества, f - энтальпия образования соответствующего вещества.
Например, для реакции горения метана можно использовать следующие данные:
| CH4(г) | -74,8 кДж/моль |
| O2(г) | 0 кДж/моль |
| CO2(г) | -393,5 кДж/моль |
| H2O(г) | -241,8 кДж/моль |
Тепловой эффект реакции горения метана можно рассчитать следующим образом:
| ΔH = (1 * -74,8) + (2 * 0) - (1 * -393,5) - (2 * -241,8) = -891,6 кДж |
Таким образом, тепловой эффект реакции горения метана равен -891,6 кДж. Знак минус указывает на то, что при данной реакции выделяется тепло.
Примеры использования теплового эффекта при постоянном объеме
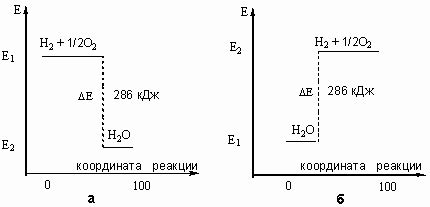
Тепловой эффект при постоянном объеме может быть использован в различных областях науки и техники. Некоторые примеры включают:
Кинетические исследования
В химических реакциях, которые происходят при постоянном объеме, можно использовать тепловой эффект для изучения скорости реакций и молекулярных взаимодействий. Путем измерения изменения теплоты можно определить энергию активации и механизм реакции.
Калибровка калориметров
Калориметры используются для измерения тепловых эффектов различных процессов, и важно проводить их калибровку. При известном изначальном количестве тепла, подаваемого или отбираемого, можно определить точность и чувствительность калориметра.
Обнаружение химических реакций
Некоторые химические реакции сопровождаются выделением или поглощением тепла. Используя тепловой эффект, можно обнаружить протекание реакции, например, изменение температуры среды или появление пузырьков при реакции в закрытом сосуде.
Это лишь некоторые примеры использования теплового эффекта при постоянном объеме. Тепловые эффекты могут быть полезными инструментами для изучения и контроля различных процессов.