Щелочные металлы и щелочноземельные металлы - это две группы элементов, которые находятся на разных местах в периодической системе химических элементов и имеют разные свойства. Несмотря на то, что оба вида металлов могут образовывать ионы водорода, они имеют некоторые важные различия.
Первое и наиболее очевидное различие между щелочными металлами и щелочноземельными металлами заключается в их положении в периодической таблице. Щелочные металлы находятся в первой группе (1A) и включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). С другой стороны, щелочноземельные металлы находятся во второй группе (2A) и включают бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Второе важное отличие между этими двумя группами металлов связано с их химическими свойствами. Щелочные металлы имеют одну валентность и образуют положительные ионы с электронной конфигурацией, подобной электронной конфигурации инертных газов. Они очень реактивны и образуют щелочные растворы, поэтому их называют "щелочными". С другой стороны, щелочноземельные металлы имеют две валентности и образуют два типа положительных ионов. Они менее реактивны и образуют щелочноземельные растворы.
Основные характеристики щелочных металлов

- Мягкость и низкая плотность: Щелочные металлы имеют мягкую текстуру и низкую плотность, что делает их легкими для обработки и использования в различных отраслях.
- Низкая температура плавления: Они обладают низкой температурой плавления, что позволяет им легко переходить из твердого состояния в жидкое состояние при невысоких температурах.
- Высокая реактивность: Щелочные металлы очень реактивны и легко вступают в химические реакции с другими элементами, особенно с водой и кислородом.
- Электроотрицательность: Они обладают низкой электроотрицательностью, что делает их хорошими ионными и металлическими проводниками электричества.
- Легкость образования ионов: Щелочные металлы легко образуют одновалентные ионы, теряя свой единственный внешний электрон, что делает их стабильными в ионной форме.
- Сильно щелочная реакция: Они образуют щелочные растворы, когда реагируют с водой, образуя гидроксиды, что обуславливает их название - щелочные металлы.
- Химическая активность: Щелочные металлы очень активни и могут реагировать с различными веществами, включая кислород, воду, галогены и многие другие.
Эти основные характеристики щелочных металлов играют важную роль в различных научных и промышленных областях и делают их важными элементами современной химии и физики.
Электроотрицательность и валентность
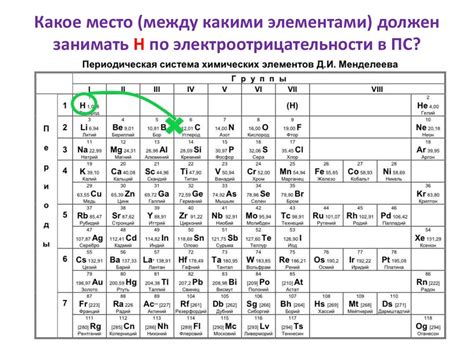
Одно из основных различий между щелочными металлами и щелочноземельными металлами заключается в их электроотрицательности и валентности.
Электроотрицательность – это способность атомов привлекать электроны к себе в химической связи. У щелочных металлов электроотрицательность низкая, а у щелочноземельных металлов она немного выше.
Валентность – это количество электронов, которые могут быть отданы или приняты атомом при образовании химической связи. Щелочные металлы имеют валентность +1, что означает, что они готовы отдать один электрон, чтобы образовать положительный ион. Щелочноземельные металлы имеют валентность +2, то есть они готовы отдать два электрона.
Из-за различия в электроотрицательности и валентности, щелочные и щелочноземельные металлы обладают разными свойствами и могут образовывать различные соединения. Это разнообразие делает эти две группы металлов важными и полезными в химических реакциях и приложениях в различных отраслях науки и промышленности.
Физические свойства

Щелочные металлы
Щелочные металлы - это первая группа периодической таблицы, которая включает литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они имеют низкую плотность и низкую температуру плавления и кипения.
Литий является наименее плотным из всех металлов, а франций имеет самую низкую температуру плавления и кипения. Все щелочные металлы обладают металлическим блеском и являются мягкими и хрупкими металлами.
Они очень реактивны и легко реагируют с водой, кислородом и другими веществами. Щелочные металлы образуют ионы с положительным зарядом и наиболее просты в периодической таблице. Их электроны внешней оболочки легко отдаются, что делает их металлами-электролитами.
Щелочноземельные металлы
Щелочноземельные металлы - это вторая группа периодической таблицы, которая включает бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они имеют высокую плотность и высокие температуры плавления и кипения по сравнению с щелочными металлами.
Щелочноземельные металлы обладают серебристо-белым металлическим блеском. Они твердые и менее мягкие, чем щелочные металлы. Щелочноземельные металлы также реактивны, но менее реактивны, чем щелочные металлы.
Щелочноземельные металлы образуют ионы с двойным положительным зарядом и внешняя электронная оболочка имеет два электрона, которые могут быть отданы. Эти металлы также используются в различных промышленных процессах и имеют множество практических применений.
Формирование оксидов и гидроксидов
Щелочные металлы обладают высокой реактивностью из-за низких ионизационных потенциалов и малых энергий ионизации. Столь низкие энергии делают эти металлы очень активными и способными к быстрой реакции с кислородом из воздуха.
При контакте с кислородом щелочные металлы образуют оксиды, такие как оксид лития (Li2O), оксид натрия (Na2O) и оксид калия (K2O). Эти оксиды являются белыми кристаллическими веществами с высокой температурой плавления и кипения.
Более того, щелочные металлы быстро реагируют с водой и образуют гидроксиды. Например, реакция натрия с водой приводит к образованию гидроксида натрия (NaOH) и выделению водорода:
2Na + 2H2O → 2NaOH + H2
Гидроксиды щелочных металлов являются щелочными соединениями и широко используются в различных отраслях промышленности и научных исследованиях.
С другой стороны, щелочноземельные металлы проявляют меньшую реактивность, поэтому образование оксидов и гидроксидов происходит более сложно и медленно. Однако, несмотря на это, бериллий, магний, кальций и другие щелочноземельные металлы также могут образовывать оксиды и гидроксиды, которые имеют свои особенности и применяются в различных сферах деятельности.
Реакция с водой

Щелочные металлы, такие как литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs), реагируют с водой, образуя гидроксид металла и выделяя водород.
| Металл | Уравнение реакции с водой |
|---|---|
| Литий (Li) | 2Li + 2H2O → 2LiOH + H2 |
| Натрий (Na) | 2Na + 2H2O → 2NaOH + H2 |
| Калий (K) | 2K + 2H2O → 2KOH + H2 |
| Рубидий (Rb) | 2Rb + 2H2O → 2RbOH + H2 |
| Цезий (Cs) | 2Cs + 2H2O → 2CsOH + H2 |
Щелочноземельные металлы, такие как бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr) и барий (Ba), также реагируют с водой, но их реакция происходит намного медленнее и менее интенсивно. В результате реакции с водой образуется гидроксид металла и выделяется водород.
| Металл | Уравнение реакции с водой |
|---|---|
| Бериллий (Be) | Be + 2H2O → Be(OH)2 + H2 |
| Магний (Mg) | Mg + 2H2O → Mg(OH)2 + H2 |
| Кальций (Ca) | Ca + 2H2O → Ca(OH)2 + H2 |
| Стронций (Sr) | Sr + 2H2O → Sr(OH)2 + H2 |
| Барий (Ba) | Ba + 2H2O → Ba(OH)2 + H2 |
Основные характеристики щелочноземельных металлов

1. Атомная структура: Щелочноземельные металлы имеют два электрона в орбитали s, что делает их самыми электронно-положительными элементами. Это обусловлено строением электронной оболочки, где на внешней оболочке находятся два электрона.
2. Активность: Щелочноземельные металлы более реактивны, чем щелочные металлы. Они легко реагируют с кислородом, водой и некоторыми другими веществами. Например, магний горит в воздухе при нагревании, а бериллий не образует сильную щелочь в контакте с водой.
3. Плотность и твердость: Щелочноземельные металлы имеют большую плотность и твердость по сравнению с щелочными металлами. Например, барий и радий обладают высокой плотностью и твердостью, а бериллий – наименьшей из всех щелочноземельных металлов.
4. Использование в промышленности: Основные характеристики щелочноземельных металлов определяют их применение в разных областях промышленности. Например, кальций используется для производства цемента и стали, стронций применяется в производстве пиротехники, а барий используется в медицине для рентгеновских исследований.
| Металл | Атомный номер | Плотность (г/см³) | Температура плавления (°C) |
|---|---|---|---|
| Бериллий | 4 | 1.85 | 1287 |
| Магний | 12 | 1.74 | 650 |
| Кальций | 20 | 1.55 | 842 |
| Стронций | 38 | 2.63 | 769 |
| Барий | 56 | 3.62 | 727 |
| Радий | 88 | 5.5 | 700 |
Таблица показывает значения плотности и температуры плавления для каждого из щелочноземельных металлов. Плотность и температура плавления увеличиваются с увеличением атомного номера. Например, ртуть легче всех металлов щелочноземельных элементов и является жидким при комнатной температуре, в то время как радий является наиболее твердым и тяжелым.
Электроотрицательность и валентность

Валентность, или степень окисления, определяет количество химических связей, которые может образовать атом элемента. Она зависит от количества электронов в внешней электронной оболочке и обычно равна количеству электронов в s- и p-орбиталях внешней оболочки.
У щелочных металлов (группа 1) валентность составляет одну, так как они имеют один электрон в внешней s-орбитали. Это означает, что щелочные металлы могут образовывать только одну химическую связь и обычно образуют ион с однозарядным положительным зарядом.
Валентность щелочноземельных металлов (группа 2) составляет две, так как они имеют два электрона в внешней s-орбитали. Это означает, что щелочноземельные металлы могут образовывать две химических связи и образуют ионы с двухзарядным положительным зарядом.
Таким образом, основным различием между щелочными металлами и щелочноземельными металлами является их валентность. Щелочные металлы имеют валентность один, а щелочноземельные металлы - два.
Физические свойства

У щелочных металлов очень низкая электроотрицательность, что делает их хорошими ионными металлами. Это означает, что они легко отдают свои электроны и образуют ионы положительного заряда.
Напротив, щелочноземельные металлы, такие как бериллий, магний, кальций, стронций, барий и радий, обладают другим набором физических свойств. Они также являются металлами, но в отличие от щелочных металлов они являются более плотными и твердыми.
У щелочноземельных металлов выше электроотрицательность по сравнению с щелочными металлами, поэтому они менее активны и менее склонны образовывать ионы.
Оба класса металлов обладают низкой температурой плавления и кипения, а также хорошей теплопроводностью и электропроводностью.
Формирование оксидов и гидроксидов

Например, литий образует литиевый оксид (Li2O), натрий - натриевый оксид (Na2O), калий - калиевый оксид (K2O) и так далее. Эти оксиды обычно являются твердыми веществами и могут реагировать с водой, образуя соответствующие гидроксиды. Например, литиевый оксид реагирует с водой, образуя литиевый гидроксид (LiOH).
В отличие от щелочных металлов, щелочноземельные металлы формируют более стабильные оксиды и гидроксиды благодаря своему высокому сродству к кислороду. Например, магний образует магниевый оксид (MgO), который обладает алкалическими свойствами, но значительно менее выраженными по сравнению с оксидами щелочных металлов.
Щелочные металлы и щелочноземельные металлы также отличаются в своей реакции с водой. Щелочные металлы реагируют с водой значительно более активно, образуя гидроксид и выделяя водород. Например, натрий реагирует с водой, образуя натриевый гидроксид (NaOH) и выделяя водородный газ (H2), тогда как магний реагирует с водой намного медленнее и вода не вступает в реакцию с гидроксидом магния (Mg(OH)2).
Реакция с водой

Щелочные металлы, такие как литий, натрий и калий, реагируют с водой, образуя щелочь и выделяя водород. Реакция протекает очень быстро и с высоким выделением тепла. Например, если бросить небольшой кусок натрия в воду, он мгновенно загорится, превращаясь в ярко-желтую пламенную сферу.
Щелочноземельные металлы, такие как магний, кальций и стронций, также реагируют с водой, но гораздо медленнее и менее ярко, по сравнению с щелочными металлами. Реакция происходит под образованием щелочи и выделением водорода, но тепло выделяется в значительно меньших количествах.
Важно отметить:
Реакция щелочных металлов с водой является очень опасной и проводится только в специальных условиях и при наличии надлежащего оборудования. Это связано с высокой активностью и реактивностью этих веществ, что может привести к серьезным последствиям, таким как взрывы или ожоги.