Металлы и неметаллы – это две основные группы элементов, из которых состоит периодическая система химических элементов. Атомы металлов и атомы неметаллов имеют существенные отличия, определяющие их свойства и реакционную способность.
Атомы металлов обычно имеют маленькую электроотрицательность и отдают электроны, образуя положительно заряженные ионы. Металлы обладают высокой теплопроводностью и электропроводностью благодаря свободным электронам в своей кристаллической решетке. Благодаря этому металлы являются хорошими проводниками тока и тепла. Они также способны образовывать металлическое связи, при котором атомы металла образуют ионный кристалл, состоящий из положительно заряженных ядер и свободных электронов.
В отличие от металлов, атомы неметаллов обычно имеют большую электроотрицательность. Это означает, что они имеют большую электронную аффинность и способны принимать электроны, образуя отрицательно заряженные ионы. Неметаллы в общем случае не обладают хорошей теплопроводностью и электропроводностью. Они образуют собой ковалентные связи, при которых атомы неметаллов обменивают электроны, образуя молекулы. Это обмен электронами позволяет неметаллам образовывать различные соединения, включая сложные органические соединения.
В чем разница между атомами металлов и атомами неметаллов?
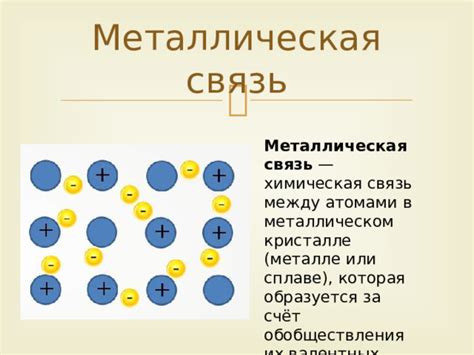
Атомы металлов и атомы неметаллов имеют ряд существенных различий, определяющих их свойства и способности взаимодействия. Основные различия между ними связаны с электронной структурой и химическими свойствами.
Металлические атомы обычно имеют мало электронов в своей внешней электронной оболочке, что делает их склонными к потере электронов и образованию положительно заряженных ионов. Атомы неметаллов, напротив, имеют больше электронов в своей внешней электронной оболочке, что делает их склонными к принятию электронов и образованию отрицательно заряженных ионов.
Кроме того, атомы металлов обычно имеют больший размер и меньшую электроотрицательность, что делает их более склонными к образованию сильных металлических связей и хорошими проводниками тепла и электричества. Атомы неметаллов, наоборот, имеют меньший размер и большую электроотрицательность, что делает их склонными к образованию ковалентных связей и хорошими изоляторами.
Кроме этих основных различий, атомы металлов и неметаллов также имеют различные физические свойства, такие как плотность, температура плавления и теплопроводность. Например, большинство металлов являются твердыми при комнатной температуре, имеют высокую плотность и хорошую теплопроводность, тогда как неметаллы могут быть твердыми, жидкими или газообразными и иметь различную плотность и химическую активность.
Итак, атомы металлов и атомы неметаллов существенно отличаются по своей электронной структуре, химическим свойствам и физическим параметрам, что определяет их различное поведение в химических реакциях и их использование в различных отраслях науки и промышленности.
Строение атомов: основная характеристика
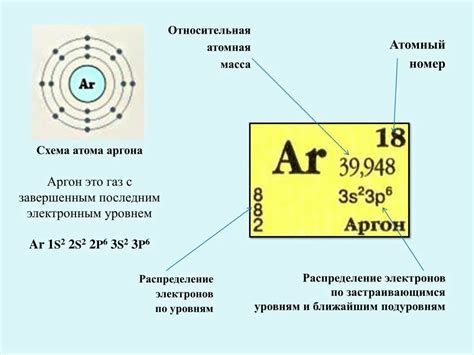
Атомы металлов и атомы неметаллов имеют отличия в своем строении, которые определяют их химические свойства и поведение в химических реакциях.
| Металлы | Неметаллы |
|---|---|
| Металлы обычно имеют малое количество электронов на внешнем энергетическом уровне. Это делает их склонными к потере электронов и образованию положительных ионов, или катионов. | Неметаллы, напротив, имеют большое количество электронов на внешнем энергетическом уровне. Они обычно стремятся к получению дополнительных электронов и образованию отрицательных ионов, или анионов. |
| Металлические атомы обладают высокой подвижностью электронов, что позволяет им образовывать металлические связи и образовывать кристаллическую структуру в твердом состоянии. | Атомы неметаллов имеют меньшую подвижность электронов и образуют сильные ковалентные связи между собой, что приводит к образованию молекул и более сложной структуре в твердом состоянии. |
| Металлы хорошие проводники электричества и тепла, так как свободные электроны могут свободно двигаться внутри металлической структуры. | Неметаллы плохие проводники электричества и тепла, так как электроны тесно связаны в ковалентных связях и не могут свободно двигаться по материалу. |
Эти различия в строении атомов металлов и неметаллов определяют их химические свойства и влияют на их способность образовывать химические соединения, проводить электричество и тепло, а также на их физические свойства, такие как температура плавления и кипения.
Физические свойства: отличия металлов от неметаллов
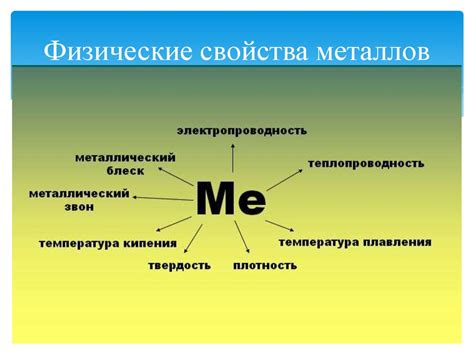
Вот основные отличия между атомами металлов и атомами неметаллов:
| Металлы | Неметаллы |
|---|---|
| Имеют высокую плотность и твердость | Обычно обладают низкой плотностью и мягкостью |
| Обладают высокой теплопроводностью и электропроводностью | Обычно не проводят тепло и электричество хорошо |
| Часто имеют металлический блеск и отражают свет | Часто имеют матовую или прозрачную поверхность |
| Гибкие и пластичные, могут быть расплывчатыми при нагревании | Жесткие и хрупкие, нагревание часто приводит к разрушению |
| Образуют положительные ионы | Образуют отрицательные ионы |
Такие различия в физических свойствах определяют возможности использования металлов и неметаллов в различных областях науки и промышленности.
Химические свойства: разнообразие взаимодействий

Химические свойства атомов металлов и неметаллов отличаются друг от друга в своих взаимодействиях с другими элементами. Атомы металлов, благодаря своему строению и общей наличности электронов, имеют склонность сдавать электроны и образовывать ионы положительного заряда. Это свойство называется металлической связью.
В то время как атомы неметаллов имеют большую афинность к электронам и склонность к получению дополнительных электронов. Они образуют ионы с отрицательным зарядом или образуют ковалентные связи с другими атомами, образуя молекулы.
Химические реакции атомов металлов обычно проявляются в окислительно-восстановительных процессах, где металл сдает электроны (осуществляет «окисление») и, таким образом, позволяет другим компонентам вещества получать электроны (это называется «восстановление»).
Взаимодействие атомов неметаллов охватывает широкий спектр реакций, таких как образование ковалентных связей, образование сольных соединений, окислительно-восстановительные реакции и многие другие. Для неметаллов характерными свойствами являются их высокая электроотрицательность, храктерный своеобразный запах, наличие нековкой и хрупкой природы в твердом состоянии и т.д.
Таким образом, разнообразие взаимодействий атомов металлов и неметаллов определяется их уникальными химическими свойствами, которые влияют на их способность образовывать соединения и вступать в химические реакции.
Электронная конфигурация: распределение электронов
Атомы металлов и атомы неметаллов отличаются в своей электронной конфигурации, то есть в распределении электронов по энергетическим уровням и оболочкам.
У атомов металлов электроны распределены таким образом, что внешние энергетические уровни (валентные уровни) обычно имеют меньше электронов, чем внутренние уровни. Это делает атомы металлов склонными к потере электронов и образованию ионов с положительным зарядом. Потеря электронов позволяет атомам металлов стать катионами и образовывать ионные соединения с атомами неметаллов.
С другой стороны, атомы неметаллов имеют больше электронов на внешнем энергетическом уровне, что делает их склонными к приобретению дополнительных электронов и образованию ионов с отрицательным зарядом. Приобретение электронов позволяет атомам неметаллов стать анионами и образовывать ионные соединения с атомами металлов.
Распределение электронов в атоме металла или неметалла определяется электронной строением атома, которое задается электронной конфигурацией. Электронная конфигурация определяет количество электронов на каждом энергетическом уровне и оболочке атома.
Кроме того, атомы металлов и неметаллов имеют разный размер и связанное с этим разное притяжение электронов к ядру. Это также влияет на их химические свойства и способность образовывать химические связи с другими атомами.
Роль в природе: участие в химических процессах
Атомы металлов и неметаллов играют важную роль в различных химических процессах в природе. Они участвуют в формировании химических соединений, оказывают влияние на физические свойства веществ и имеют большое значение для живых организмов.
Атомы металлов обладают свойствами, которые делают их активными участниками в реакциях. Они имеют маленький размер, низкую электроотрицательность и способность отдавать электроны другим атомам. Благодаря этим свойствам, металлы образуют положительные ионы, которые способны образовывать соли и металлические соединения.
Атомы неметаллов, напротив, имеют большую электроотрицательность и обладают способностью принимать электроны от других атомов. Они образуют отрицательные ионы и обычно образуют ковалентные соединения. Неметаллы играют важную роль в образовании органических соединений, включая биологически активные вещества.
Металлы и неметаллы взаимодействуют друг с другом, образуя химические соединения. Эти соединения могут иметь различную степень и характер связей. Такие соединения, как соли, оксиды и кислоты, являются основополагающими компонентами веществ, которые окружают нас в повседневной жизни. Они обладают свойствами, которые делают их полезными в различных областях, таких как промышленность, медицина и сельское хозяйство.
В живых организмах атомы металлов и неметаллов играют ключевую роль в различных биологических процессах. Они участвуют в образовании молекул, таких как белки, нуклеиновые кислоты и гормоны. Они также являются необходимыми элементами для функционирования организма, такие как кальций, железо и йод, которые играют важную роль в обмене веществ, регуляции физиологических процессов и поддержании здоровья.
Таким образом, атомы металлов и неметаллов имеют огромное значение для природы и жизни на Земле. Их участие в химических процессах обеспечивает разнообразие веществ и процессов, что делает их неотъемлемыми частями нашего мира.