Количество вещества – это одна из фундаментальных физических величин, которая играет важную роль в химии и физике. В системе Международных СИ (Системы единиц), единицей измерения количества вещества является моль, обозначаемая символом "мол".
Моль определяется как количество вещества, содержащее столько элементарных единиц, сколько атомов содержится в 0,012 кг изотопа углерода-12. Таким образом, моль является основной единицей измерения количества вещества и используется для измерения количества атомов, молекул, ионов и других частиц вещества.
Количество вещества является важным понятием в химических расчётах, так как позволяет определить точное соотношение реагентов и продуктов химической реакции. Оно позволяет проводить точные расчёты по составу вещества, массе, объему и другим физическим характеристикам.
Использование молярных величин позволяет связать массу и количество вещества. Молярная масса - это масса одного моля вещества. Она выражается в г/моль и определяется с помощью атомных масс и расчетов на основе строения молекулы.
Что такое количество вещества?

Моль является стандартной единицей количества вещества и определяется как количество вещества, содержащее столько частиц, сколько атомов содержится в 12 граммах углерода-12. Это число называется постоянной Авогадро и приближенно равно 6,022 × 10^23.
Количество вещества позволяет связать массу вещества с количеством его частиц. Таким образом, позволяет установить фундаментальную связь между массой и числом частиц вещества. Количество вещества играет важную роль в химии, физике и других науках, где изучаются свойства и взаимодействия вещества.
Использование количества вещества позволяет более точно сравнивать и измерять взаимодействия, реакции и превращения вещества, а также определять состав и структуру материала. Это важное понятие позволяет установить связь между микроскопическими и макроскопическими свойствами вещества.
Определение и значение в химии

Определение количества вещества важно для проведения химических расчетов и определения степеней реакций между веществами. Количество вещества позволяет указать, сколько молекул, атомов или ионов содержится в данном объеме вещества.
Количество вещества можно выразить через массу и молярную массу. Молярная масса - это масса одного моля вещества. Связь между количеством вещества, массой и молярной массой задается формулой:
n = m/M
где:
n - количество вещества;
m - масса вещества;
M - молярная масса вещества.
Количество вещества является фундаментальной величиной в химии и играет важную роль во всех химических расчетах и концепциях. Оно позволяет определить количество реагентов и продуктов, а также производить сравнение различных веществ и реакций.
Как измеряется количество вещества?

Моль определена как количество вещества, содержащего столько элементарных единиц, сколько атомов содержится в 0,012 кг чистого изотопа углерода-12. Это число равно приблизительно 6,022 x 10^23 атомов и называется числом Авогадро.
Для измерения количества вещества в молях используется молярная масса. Молярная масса - это масса одного моля вещества и измеряется в г/моль. Она равна числовому значению массы вещества в граммах, деленной на количество вещества в молях. Молярная масса обозначается символом "M".
Количество вещества можно измерить как отношение массы вещества к его молярной массе по формуле:
Количество вещества (в молях) = Масса (в граммах) / Молярная масса (в г/моль).
Таким образом, для измерения количества вещества в системе СИ используется моль, а для расчета количества вещества используется молярная масса.
Единица измерения моль
Моль является базовой единицей для измерения количества вещества и соответствует абсолютной понятию числа: одна моль равна числу атомов, содержащихся в 12 г атомарного углерода 12. Эта стандартная величина называется числом Авогадро и составляет примерно 6,02214076 × 1023.
Для облегчения использования моль в химических расчетах, было введено понятие молярной массы. Молярная масса измеряется в г/моль и является массой одного моля вещества. Чтобы найти массу вещества, нужно умножить количество молей на его молярную массу.
| Вещество | Молярная масса (г/моль) |
|---|---|
| Кислород (O2) | 32,0 |
| Вода (H2O) | 18,0 |
| Аммиак (NH3) | 17,0 |
| Углекислый газ (CO2) | 44,0 |
Таким образом, единица измерения моль является ключевым понятием в химии и используется для количественного описания вещества и проведения химических расчетов.
Зачем нужна единица измерения моль?

Моль является важным понятием в химии, физике и других естественных науках. Она позволяет установить точное количество атомов, молекул или частиц вещества.
Моль используется для преобразования массы вещества в его количество в молекулярной шкале. Важно понимать, что масса вещества может отличаться, но количество частиц останется неизменным при условии, что это одно и то же вещество.
Величина одной моли соответствует числу атомов, равному числу атомов углерода в 0,012 кг (12 г) углерода-12. Этот эквивалент относится ко всем элементам, и он называется постоянной Авогадро.
Использование моли позволяет производить точные вычисления в химических реакциях и уравнениях. Она помогает химикам определить соотношение между реагентами и продуктами, молярные массы веществ и другие важные параметры.
Также, моль используется для измерения тепловых эффектов химических реакций и фазовых переходов вещества.
Итак, единица измерения моль играет ключевую роль в химических и физических исследованиях, позволяя устанавливать связи между массой и количеством вещества и проводить точные расчеты в химических реакциях.
Применение в различных областях науки

В химии количество вещества используется для расчета стехиометрических соотношений в химических реакциях. Оно позволяет определить, сколько вещества участвует в реакции, а также прогнозировать количество продуктов реакции.
В физике количество вещества используется для расчета числа частиц (атомов, молекул, ионов и т.д.) вещества или системы. Это позволяет определить массу, объем или другие физические параметры, связанные с числом частиц.
В биологии и медицине количество вещества используется для определения концентрации протеинов, гормонов, витаминов, лекарственных веществ и других веществ в организме. Это помогает установить наличие патологических состояний или эффективность лечения.
Количество вещества также находит применение в материаловедении, экологии, геологии и других научных дисциплинах. Оно позволяет проводить анализ химического состава материалов, определять загрязнение окружающей среды и изучать природные процессы.
Взаимосвязь количества вещества и массы
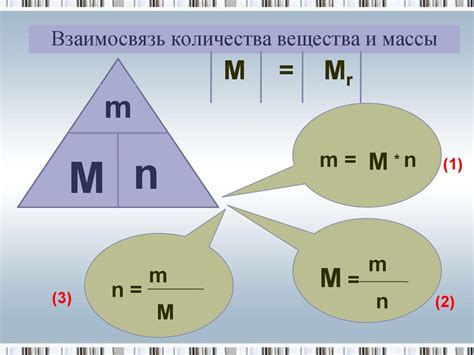
Когда речь идет о количестве вещества, масса играет важную роль. Масса вещества можно определить, зная количество вещества и молярную массу этого вещества. Молярная масса - это масса одного моля вещества. Она выражается в граммах на моль (g/mol).
Для вычисления массы вещества по количеству вещества используется следующая формула:
| Масса (m) | = | Количество вещества (n) | * | Молярная масса (M) |
|---|
Таким образом, масса вещества равна произведению количества вещества и молярной массы. Эта формула позволяет установить связь между количеством вещества и массой вещества.
Например, если у нас есть 2 моли кислорода (O2), а молярная масса кислорода равна 32 г/моль, мы можем использовать формулу для определения массы кислорода:
| Масса (m) | = | 2 моля (n) | * | 32 г/моль (M) | = | 64 г |
|---|
Таким образом, масса кислорода равна 64 г.
Использование количества вещества вместе с массой позволяет установить точные и относительные соотношения между веществами. Это особенно полезно при проведении химических реакций и расчетах реакционных стехиометрических коэффициентов.