Гидроксид магния (Mg(OH)2) – это химическое соединение, состоящее из атомов магния, кислорода и водорода. Он обладает низкой растворимостью в воде и является непрозрачным, белым веществом.
Одной из интересных особенностей гидроксида магния является его способность к разложению при нагревании. При нагревании гидроксид магния происходит дезгидратация, то есть отделение молекул воды от основного соединения. Температура разложения гидроксида магния составляет около 350 градусов Цельсия.
Гидроксид магния при нагревании дает оксид магния и воду:
Mg(OH)2 → MgO + H2O
Разложение гидроксида магния является эзотермическим процессом, то есть сопровождается выделением тепла. Это легко можно наблюдать на практике – при нагревании гидроксида магния в закрытой посуде образуется пар воды.
Разложенный гидроксид магния, полученный в результате нагревания, называется оксидом магния или перегоревшим магнием. Он обладает белым цветом и применяется в различных областях, включая производство огнеупорных материалов, стекла, керамической и химической промышленности.
Свойства гидроксида магния
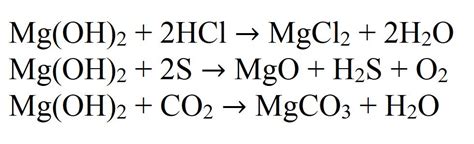
Во-первых, гидроксид магния является белой кристаллической субстанцией, встречающейся в природе в виде магнезита. Он обладает слабым амфотерным поведением, что означает, что он может реагировать как с кислотами, так и с щелочами.
Гидроксид магния обладает хорошей растворимостью в воде. При этом он образует осадок, который обладает благотворными свойствами для кожи. Именно поэтому гидроксид магния активно используется в производстве косметических средств и средств по уходу за кожей.
Одним из самых известных свойств гидроксида магния является его способность нейтрализовать кислоты. Это свойство является основой применения гидроксида магния в лекарственной промышленности для создания препаратов, предназначенных для уменьшения избытка соляной кислоты в желудке и снятия изжоги.
Кроме того, гидроксид магния обладает слабыми антисептическими свойствами и может использоваться в качестве антисептика для лечения ран и ожогов.
Из-за своей высокой щелочности, гидроксид магния может причинить раздражение кожи или слизистых оболочек. Поэтому при работе с ним необходимо соблюдать меры предосторожности и использовать защитные средства.
Реакция разложения гидроксида магния
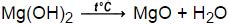
Выглядит уравнение реакции разложения гидроксида магния следующим образом:
Mg(OH)2 → MgO + H2O
В процессе нагревания гидроксида магния до достаточно высокой температуры (обычно около 350-400 °C), молекулы гидроксида разлагаются на ионы магния (Mg2+) и ионы гидроксида (OH-). Ионы гидроксида затем реагируют между собой, образуя молекулярную воду. При этом образуются твердые частицы оксида магния, которые можно видеть в виде белого порошка.
Реакция разложения гидроксида магния при нагревании является эндотермической, то есть требует поглощения тепла. Это означает, что для начала и поддержания процесса разложения необходимо обеспечить постоянное поступление тепла к реагирующему веществу.
Разложение гидроксида магния является важной реакцией из-за возможности получения оксида магния в чистом виде. Оксид магния (MgO) имеет широкий спектр применения, включая использование в качестве катализатора, сырья для производства магниевых материалов и компонентов керамики, а также в медицинских и косметических препаратах.
Таким образом, реакция разложения гидроксида магния является важным химическим процессом, позволяющим получать ценный продукт - оксид магния.
Термический процесс
Реакция разложения гидроксида магния может быть представлена следующим уравнением:
2Mg(OH)2 → 2MgO + 2H2O
Таким образом, при нагревании гидроксида магния происходит диссоциация молекул и выделение молекул воды. В результате образуется оксид магния, который является белым кристаллическим веществом с высокой температурой плавления.
Термическое разложение гидроксида магния можно рассмотреть как экзотермическую реакцию, так как при этом выделяется тепловая энергия. Это позволяет использовать процесс разложения гидроксида магния для получения теплосберегающего материала – оксида магния. Благодаря высоким температурным стабильности и низкой теплопроводности, оксид магния широко применяется в промышленности и строительстве.
Физические изменения

При нагревании гидроксида магния (Mg(OH)2) происходят физические изменения, которые можно наблюдать в ходе реакции. При нагревании Mg(OH)2 начинает выделяться вода (H2O) в виде пара, а твердая реагирующая смесь меняет цвет на белый.
Постепенно вся Mg(OH)2 превращается в твердый белый порошок - оксид магния (MgO), который остается на дне реакционной смеси. Вода, выделяющаяся при нагревании, покидает смесь в виде пара. Таким образом, физические изменения включают образование нового вещества (MgO) и уход воды в виде пара.
Для наглядности и более точного описания физических изменений в ходе разложения гидроксида магния, представим их в виде таблицы.
| Начальное состояние | Промежуточное состояние | Конечное состояние |
|---|---|---|
| Гидроксид магния (белый порошок) | Гидроксид магния нагревается | Оксид магния (белый порошок) |
| Вода (часть гидроксида магния) | Вода испаряется в виде пара | Отсутствует |
Химические изменения

2Mg(OH)2 → 2MgO + 2H2O
В результате нагревания гидроксида магния образуются оксид магния (MgO) и вода (H2O). Это является примером химической реакции, при которой исходные вещества претерпевают изменения своей структуры и состава.
Такой процесс разложения гидроксида магния при нагревании можно объяснить следующим образом: при под действием температуры молекулы гидроксида магния теряют воду, образуя оксид магния и молекулы воды. Таким образом, химическая связь между магнием и гидроксидной группой разрушается, образуется новая химическая связь между магнием и кислородом из гидроксида, а также новая химическая связь между кислородом и водородом.
Такие химические реакции важны и широко применяются в различных областях науки и техники, в частности, в химическом производстве, при производстве материалов, в медицине и других отраслях. Изучение таких процессов позволяет более глубоко понять свойства веществ и применять их в практических целях.
Катализаторы реакции
Катализаторы играют важную роль в реакции разложения гидроксида магния при нагревании. Они ускоряют химическую реакцию, не участвуя в ней самостоятельно.
Процесс разложения гидроксида магния начинается при достижении определенной температуры. Однако, без катализаторов, реакция может протекать медленно или даже не начинаться вообще.
Одним из катализаторов может быть металлический сплав, содержащий платину или палладий. Эти металлы обладают активной поверхностью, на которой реакция происходит быстрее.
Другим примером катализатора может быть марганец (IV) оксид. Этот соединение также ускоряет разложение гидроксида магния и повышает скорость реакции.
Иногда используются и другие катализаторы, такие как наночастицы золота или палладия, или даже ферменты, которые обладают способностью активировать химическую реакцию.
Выбор катализатора зависит от специфики реакции и условий ее проведения. Использование катализаторов может значительно сократить время реакции и повысить ее эффективность.
Практическое применение

Разложение гидроксида магния при нагревании имеет широкое практическое применение в различных областях.
Производство магния и его соединений. Гидроксид магния является одним из основных источников магния. Путем разложения гидроксида магния при высокой температуре получают магний оксид, который затем используется для производства различных соединений магния, таких как магния нитрат, магния хлорид и т.д. Эти соединения магния находят применение в производстве огнеупорных материалов, удобрений, косметических и медицинских препаратов.
Утилизация отходов. Гидроксид магния, полученный из разложения гипоксида магния, может быть использован для утилизации отходов. Он является натуральным абсорбентом и может быть использован для обработки и очистки воды, сжигания отходов и улавливания токсичных веществ.
Производство огнеупорных материалов. Магний оксид, получаемый из разложения гидроксида магния, является основным компонентом огнеупорных материалов. Эти материалы применяются в строительстве, металлургии, химической промышленности и других отраслях, где необходима высокая огнеупорность материалов.
Косметическая и медицинская промышленность. Магний оксид, полученный из разложения гидроксида магния, находит применение в косметической и медицинской промышленности. Он используется в производстве дезодорантов, кремов, пудр и других средств ухода за кожей и волосами. Кроме того, магний оксид имеет противовоспалительные и антисептические свойства, поэтому применяется в медицине при лечении ран, ожогов, ссадин и других кожных заболеваний.
Таким образом, разложение гидроксида магния при нагревании имеет широкое практическое применение в различных областях, включая производство магния и его соединений, утилизацию отходов, производство огнеупорных материалов, а также в косметической и медицинской промышленности.