Атомная орбиталь - это область пространства вокруг атомного ядра, где существует вероятность обнаружения электрона. Орбитали используются в химии для представления электронной структуры атома и объяснения его химических свойств.
Атомные орбитали различаются по форме и энергии, и описываются квантовыми числами, такими как главное, орбитальное и магнитное квантовые числа. Главное квантовое число определяет энергию орбитали и расстояние от ядра, орбитальное квантовое число - форму орбитали (s, p, d, f), а магнитное квантовое число - ориентацию орбитали в пространстве.
Орбитали s имеют сферическую форму и находятся ближе к ядру. Они вмещают максимум два электрона. Орбитали p имеют форму шарового конуса и имеют три представленные ориентации: px, py и pz. Каждая орбиталь p может вместить максимум шесть электронов.
Распределение электронов в атомных орбиталях определяет химические свойства элемента. Например, элементы с заполненными s- и p-орбиталями в своей внешней оболочке обладают наиболее стабильной электронной конфигурацией и называются инертными газами. Оставшиеся элементы, у которых d- или f-орбитали не заполнены, могут образовывать различные химические соединения и проявлять разные химические свойства.
Атомная орбиталь - основа химической связи
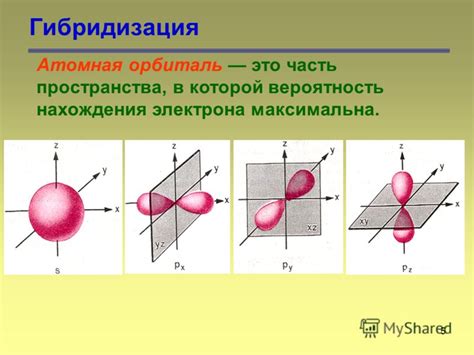
Каждая атомная орбиталь имеет свою форму, называемую формами орбиталей. Существуют четыре основных формы орбиталей: s, p, d и f. Каждая форма орбитали имеет разное количество подорбиталей и ориентаций в пространстве.
Важным свойством атомных орбиталей является их энергетическая структура. Орбитали могут быть заполнены электронами в соответствии с принципом заполнения: сначала заполняются орбитали на более низких энергетических уровнях, затем на более высоких.
Атомная орбиталь играет ключевую роль в образовании химической связи между атомами. При взаимодействии атомов образуются молекулы, в которых атомные орбитали перекрываются. Это перекрытие орбиталей позволяет электронам двух атомов находиться в области пространства между ними, создавая химическую связь.
Химическая связь может быть формирована различными типами орбитального перекрытия, такими как s-s, s-p, p-p и др. Каждый тип перекрытия имеет свою силу и характер связи.
Таким образом, атомная орбиталь является основой химической связи. Изучение орбиталей и их взаимодействия позволяет понять, как образуются химические соединения и как происходят химические реакции.
Структура атомной орбитали
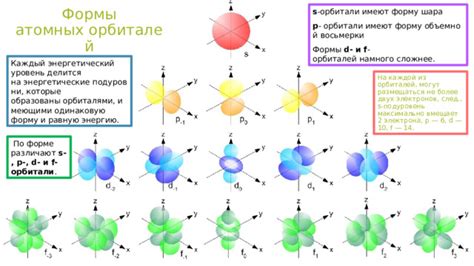
Атомная орбиталь представляет собой трехмерное пространственное распределение вероятностей, в котором может находиться электрон в атоме. В зависимости от энергии электрона, его орбиталь может изменять форму и размер.
Структура атомной орбитали определяется четырьмя главными квантовыми числами: главным квантовым числом n, орбитальным квантовым числом l, магнитным квантовым числом m и спиновым квантовым числом s.
Главное квантовое число n определяет энергию орбитали и ее расстояние от ядра атома. Оно может быть равно любому целому положительному числу больше нуля.
Орбитальное квантовое число l определяет форму орбитали и может быть равно числам от 0 до n-1. Для каждого значения l существует соответствующее подуровнение (s, p, d, f), которое характеризует форму орбитали.
Магнитное квантовое число m определяет ориентацию орбитали в пространстве и может меняться от -l до l.
Спиновое квантовое число s определяет направление вращения электрона вокруг своей оси и может быть равно 1/2 или -1/2.
Таким образом, структура атомной орбитали определяется комбинацией этих квантовых чисел, и каждая орбиталь может содержать не более двух электронов с противоположными спинами.
Работа атомной орбитали в химических реакциях

Атомные орбитали играют важную роль в химических реакциях, поскольку они определяют распределение электронов вокруг атома. Электроны, находящиеся в атомных орбиталях, участвуют в образовании химических связей и взаимодействуют с другими атомами. Это позволяет атомам образовывать молекулы и проводить различные химические превращения.
В процессе химической реакции атомные орбитали могут переходить из одного состояния в другое. Например, орбиталь может быть заполнена электронами, и когда атом взаимодействует с другим атомом, электроны могут переходить на орбитали другого атома. Это может привести к образованию новых химических связей и образованию продуктов реакции.
Тип атомной орбитали и ее энергия также играют важную роль в химических реакциях. Некоторые орбитали имеют более высокую энергию, что делает их более доступными для взаимодействия с другими атомами. Другие орбитали могут иметь более низкую энергию и быть занятыми электронами более плотно, что делает их менее доступными для реакций.
Таким образом, атомные орбитали определяют, какие электроны будут участвовать в реакции, какие связи будут образовываться между атомами, а также как будут изменяться энергия и структура молекулы в процессе реакции. Понимание работы атомных орбиталей позволяет химикам прогнозировать химические связи и реакции, используя теории и модели, основанные на квантовой механике.