Атом хлора и ион хлора являются двумя разными формами химического элемента хлора, которые имеют фундаментальные различия в своей зарядке и структуре. Процесс ионизации, приводящий к образованию иона хлора, возникает при потере или приобретении электронов атомом хлора, что приводит к изменению зарядового состояния.
Атом хлора обладает электрическим нейтральным зарядом, так как число протонов, расположенных в ядре, равно числу электронов, находящихся на энергетических уровнях. Структура атома хлора состоит из ядра, содержащего 17 протонов и некоторое количество нейтронов, окруженного облаком электронов, количественно равным 17. Атом имеет семь энергетических уровней, на которых расположены электроны в соответствии с правилом заполнения подобными подуровнями и возможностью расположения не более 2 электронов в одном орбитальном уровне.
С другой стороны, ион хлора обладает отрицательным или положительным зарядом, который возникает при потере или приобретении электрона атомом хлора. Если хлор лишает электрон, он превращается в положительно заряженный ион хлора (Cl+), называемый катионом хлора. Если хлор получает дополнительный электрон, он превращается в отрицательно заряженный ион хлора (Cl-), называемый анионом хлора. Химический символ "+" или "-" после знака хлора указывает на изменение заряда при ионизации.
Атом хлора - основы строения и зарядки
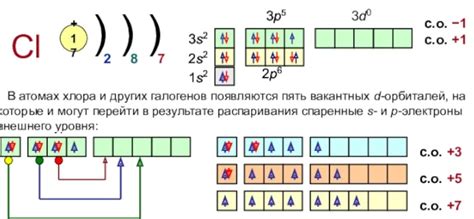
- Атом хлора состоит из ядра и электронной оболочки.
- Ядро атома хлора содержит нейтроны и протоны, которые имеют положительный заряд. Количество протонов определяет атомный номер хлора.
- Нейтроны не имеют заряда и служат для поддержания электрической стабильности ядра.
- Электронная оболочка состоит из электронов, которые обращаются по определенным орбитам вокруг ядра.
- Электроны имеют отрицательный заряд и равны числу протонов в ядре, создавая электрическую нейтральность атома.
Структура и заряд атома хлора важны для его химических свойств. Ион хлора, в свою очередь, является атомом хлора, который получил или потерял один или несколько электронов, обретая положительный или отрицательный заряд соответственно.
Электронные оболочки атома хлора
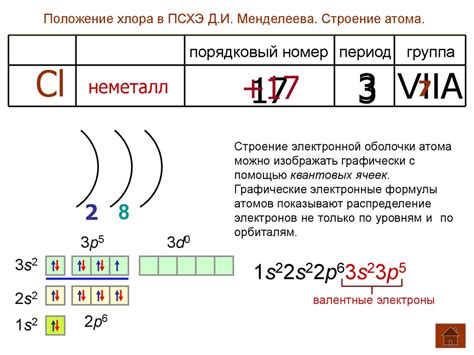
Атом хлора состоит из ядра и электронных оболочек, которые окружают это ядро. Ядро атома хлора содержит протоны и нейтроны, а вокруг него движатся электроны.
Атом хлора имеет 17 электронов, распределенных по электронным оболочкам. Первая оболочка содержит 2 электрона, а вторая оболочка содержит 8 электронов. Последняя оболочка, называемая внешней, содержит 7 электронов.
Внешняя оболочка атома хлора не заполнена полностью, поэтому атом стремится получить или отдать электроны, чтобы достичь электронной окрепости. В результате атом хлора может стать ионом хлора (Cl-), приобретя отрицательный заряд, или принять электроны от другого атома, чтобы стать положительно заряженным ионом.
Электронные оболочки атома хлора играют важную роль в его химических свойствах и взаимодействиях с другими атомами. Знание о структуре этих оболочек позволяет лучше понять характеристики и поведение атома хлора в химических реакциях.
Зарядка атома хлора
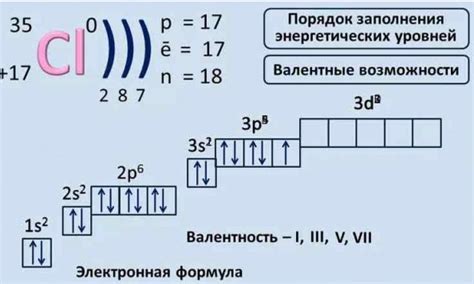
- На внешнем энергетическом уровне атом хлора содержит 7 электронов.
- На внутренних энергетических уровнях атом хлора содержит 2 и 8 электронов соответственно.
Атом хлора стремится достичь стабильной конфигурации электронов. Для этого он может взаимодействовать с другими атомами путем передачи или получения электронов. При этом атом хлора может образовать ион положительного или отрицательного заряда.
При потере одного электрона атом хлора становится положительно заряженным ионом, который называется ионом хлора. Такой ион избыточно заряжен положительно на одну элементарную единицу, то есть его заряд равен +1.
При получении одного электрона атом хлора становится отрицательно заряженным ионом, который также называется ионом хлора. Такой ион избыточно заряжен отрицательно на одну элементарную единицу, то есть его заряд равен -1.
Ионы хлора с разными зарядами имеют различные свойства и способности к химическим реакциям. Взаимодействие ионов хлора с другими элементами играет важную роль в химических процессах и позволяет образовывать различные соединения, такие как хлориды, которые являются основными соединениями хлора.
Ион хлора - обзор характеристик
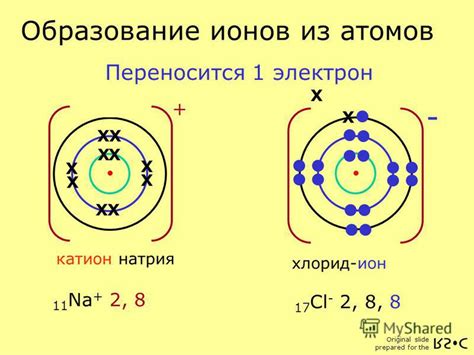
Химическая формула иона хлора представляется символом Cl-. Здесь знак "-" указывает на отрицательный заряд иона. Ион хлора обладает восемью электронами в окружности, что заполняет его внешнюю энергетическую оболочку. Это делает его стабильным и неактивным химическим веществом.
Ион хлора находится в растворенном состоянии в большинстве природных водных систем. Вода с ионом хлора может иметь характерный привкус, который часто связывают с понятием "хлорида". Ион хлора является основным компонентом натрия поваренной соли и других хлористых соединений, которые широко используются как пищевые добавки и консерванты.
Ион хлора также широко используется в промышленности, особенно для производства пластмасс, синтетических волокон, пестицидов и жидкостей для очистки воды. Он имеет высокую растворимость в воде и образует ионно-молекулярные соединения с различными веществами.
Стоит отметить, что ион хлора, подобно другим ионам, играет важную роль в жизненных процессах организмов. В организме ион хлора участвует в поддержании кислотно-щелочного баланса и обеспечении нормального функционирования клеточных мембран.
Основные характеристики иона хлора можно свести к следующему:
- Заряд: отрицательный (-1)
- Количество протонов: 17
- Количество электронов: 18
- Символ в формуле: Cl-
- Распространенность: часто встречается в природных водных системах и использовании в промышленности
Ион хлора играет важную роль в многих аспектах химии и живых систем. Его свойства и химическая активность оказывают значительное влияние на различные процессы в природе и промышленности.
Ионизация атома хлора
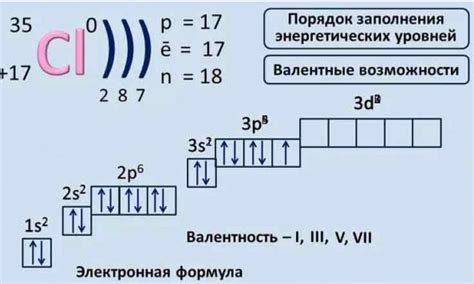
Атом хлора имеет электронную конфигурацию [Ne]3s23p5. При ионизации хлора в первый раз атом отдает один электрон, и его конфигурация становится [Ne]3s23p6. Так образуется ион Cl-, который получает негативный заряд.
Электроны внешней электронной оболочки имеют большую энергию, что позволяет им быть более доступными для потери или захвата. Из-за этого ионизация хлора происходит сравнительно легко. Полученный при ионизации ион хлора Cl- обладает семью электронами на своей валентной оболочке, что делает его стабильным.
Структура иона хлора
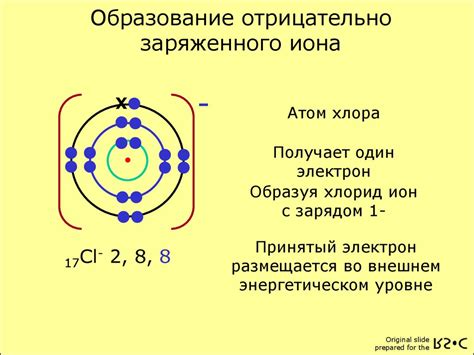
Однако, поскольку ион хлора имеет на один электрон меньше, чем атом хлора, его электронная конфигурация отличается. Ядро иона хлора остается неизменным, но количество электронов в его оболочках становится 17, вместо 18.
Ион хлора имеет октетное строение, то есть он старается достичь электронной конфигурации, которая имеет внешнюю оболочку с восемью электронами. Для этого ион хлора принимает еще один электрон от другого атома или иона. Когда ион хлора получает дополнительный электрон, он становится полностью заполненной внешней оболочкой из восьми электронов и приобретает стабильное состояние.
| Атом хлора (Cl) | Ион хлора (Cl-) |
|---|---|
| 17 протонов | 17 протонов |
| 18 электронов | 17 электронов |
Различия между атомом хлора и ионом хлора

Атом хлора состоит из 17 электронов, расположенных на трех энергетических уровнях: первом уровне находится 2 электрона, на втором - 8 электронов, а на третьем - 7 электронов. Атом хлора имеет 17 протонов и обычно также 17 нейтронов.
Ион хлора образуется, когда атом хлора приобретает или теряет один или несколько электронов. Когда атом хлора теряет один электрон, он превращается в положительно заряженный ион хлора, который обозначается Cl+. Когда атом хлора приобретает один электрон, он становится отрицательно заряженным ионом хлора, который обозначается Cl-. Ион хлора обладает 18 электронами и 17 протонами.
Различия между атомом хлора и ионом хлора связаны с их зарядом и структурой. В то время как атом хлора имеет равное количество протонов и электронов, ион хлора имеет отличное количество электронов и протонов, что делает его заряженным. Эти различия в заряде обусловлены тем, что атом хлора может либо отдавать, либо принимать электроны для достижения стабильной электронной конфигурации.