Степень окисления и валентность являются двумя важными понятиями в химии, которые часто используются для описания и классификации элементов и соединений. Однако, эти термины отличаются друг от друга и имеют свои особенности.
Степень окисления - это числовое значение, которое указывает на количество электронов, переданных атомом во время окисления или восстановления. Она помогает определить, какие атомы в соединении являются окислителями, а какие - восстановителями. Степень окисления может быть положительной, отрицательной или равной нулю. Например, водород (H) в большинстве соединений имеет степень окисления +1, кислород (O) -2, а fluor (F) всегда имеет степень окисления -1.
Валентность - это количество электронов, которые атом может отдать или принять для достижения электронной конфигурации инертного газа. Валентность атома вещества может быть положительной, отрицательной или равной нулю. Например, водород (H) имеет валентность 1, кислород (O) -2, аллюминий (Al) -3. Валентность играет важную роль при определении физических и химических свойств элементов и их соединений.
Таким образом, степень окисления и валентность, хотя и тесно связаны, имеют различия и выполняют разные функции. Степень окисления отражает изменение электронной конфигурации атома во время реакции, тогда как валентность определяет, сколько электронов атом желает передать или принять. Понимание этих понятий помогает углубить знания о взаимодействии элементов и соединений в химических реакциях и обуславливает их разнообразные химические свойства.
Что такое степень окисления и валентность?
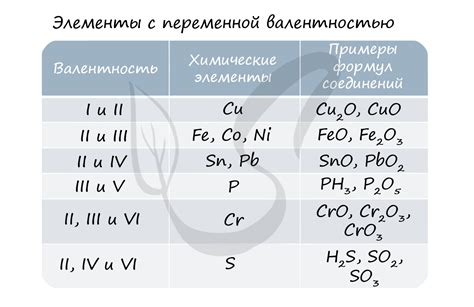
Степень окисления (окислительное число) выражает относительную зарядность или электронную составляющую атома или иона в соединении. Она определяется путем сопоставления электроотрицательностей атомов в соединении и делением общего заряда на количество атомов.
Валентность – это количество электронов, которые атом имеет в своей внешней электронной оболочке и готов отдать или принять при образовании химической связи. Она является константной для данного атома и не зависит от других атомов в соединении.
Степень окисления и валентность являются важными показателями, используемыми для определения химических формул и свойств соединений, а также реакций и окислительно-восстановительных процессов.
Определение и понятия

Валентность (или степень насыщения) - это числовое значение, которое указывает на количество связей, которые атом может образовать с другими атомами при образовании химического соединения. Валентность позволяет определить, сколько атомов других элементов может быть связано с данным атомом.
Степень окисления и валентность являются взаимосвязанными понятиями. Однако, степень окисления определяется зарядом атома в соединении, в то время как валентность определяет количество связей, которые этот атом может образовать.
Определение степени окисления и валентности является важным шагом в химических расчетах и позволяет более точно понять и предсказать химические реакции и свойства веществ. Правильное понимание и использование этих понятий помогает химикам изучать и манипулировать химическими соединениями для создания новых материалов и лекарственных препаратов, а также для решения различных практических задач.
| Понятие | Степень окисления | Валентность |
|---|---|---|
| Определение | Числовое значение, которое указывает меру электронного переноса между атомами в химическом соединении. | Числовое значение, которое указывает количество связей, которые атом может образовать с другими атомами. |
| Зависимость | Зависит от заряда атома в соединении. | Зависит от количества связей, которые атом может образовать. |
| Использование | Помогает предсказывать и понимать химические реакции и свойства веществ. | Позволяет изучать и манипулировать химическими соединениями для создания новых материалов и решения практических задач. |
Различия между степенью окисления и валентностью
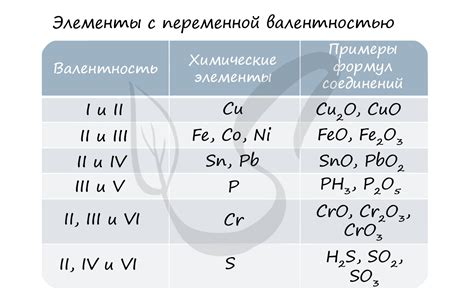
Валентность - это число, определяющее, сколько электронов может получить, отдать или разделить атом, чтобы достичь электронной стабильности. Это свойство присущее конкретному химическому элементу и обозначается обычно числом от 1 до 8.
Степень окисления, в свою очередь, отражает изменение заряда атома или иона при формировании химической связи с другими атомами или ионами. Она также может быть положительной, отрицательной или нулевой. Обозначается числом или знаком (возможно, с отрицательным значением).
Таким образом, можно сказать, что валентность свойственна элементу, в то время как степень окисления зависит от конкретной химической реакции или соединения. Валентность часто фиксирована для каждого элемента, в то время как степень окисления может изменяться в различных химических соединениях.
Важно отметить, что степень окисления и валентность связаны друг с другом, особенно в неорганической химии. Однако, они имеют разные значения и используются для разных целей.
Как определяются степень окисления и валентность?
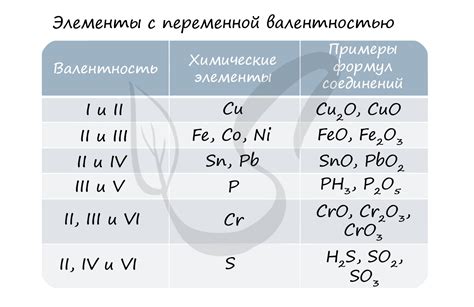
Степень окисления химического элемента определяется величиной, которая отражает количество электронов, переданных этим элементом при образовании химической связи. Для определения степени окисления необходимо рассмотреть электронную формулу соединения, а также правила анализа окружающих элементов.
Для начала следует определить общее число электронов, которые элемент должен передать, чтобы достичь электронной конфигурации инертного газа. Обычно, эта величина указывается в скобках после символа элемента. Затем необходимо анализировать электронные связи элементов с другими атомами. Как правило, при связи с более электроотрицательными элементами, степень окисления увеличивается, а при связи с менее электроотрицательными элементами - уменьшается.
Валентность химического элемента является величиной, определяющей количество связей, которые он может образовать при вступлении в химическую реакцию. Валентность химического элемента может быть представлена в виде знакового числа или стрелки.
Для определения валентности необходимо знать электронную конфигурацию элемента. Валентность равна числу электронов, находящихся во внешней энергетической оболочке атома элемента. Она связана с числом валентных электронов в атоме. Чтобы определить валентность элемента, используют таблицу Менделеева или электронную конфигурацию атома.
Необходимо отметить, что степень окисления и валентность элемента могут отличаться. Валентность - это свойство самого элемента, в то время как степень окисления зависит от конкретного соединения, в котором находится элемент.
Примеры и применение валентности и степени окисления
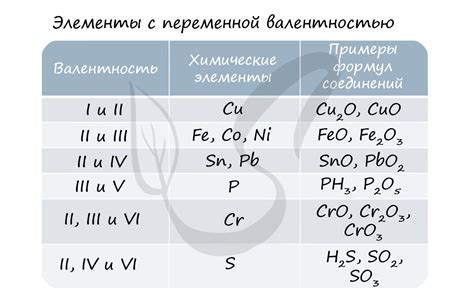
Валентность может быть использована для определения формулы соединения, так как общая валентность всех элементов в соединении должна быть равна нулю. Например, в молекуле воды (H2O) валентность кислорода равна -2, а валентность водорода равна +1. Сумма этих значений равна нулю, что указывает на сбалансированность соединения.
Степень окисления можно использовать для определения того, какие элементы входят в соединение и в каком количестве. Например, в H2O степень окисления кислорода равна -2, а водорода - +1. Это означает, что один атом кислорода может связываться с двумя атомами водорода в соединении.
Валентность и степень окисления также имеют применение в анализе химических реакций и описании свойств соединений. Они помогают определить, какие элементы окисляются или восстанавливаются в реакции, а также какие ионы образуются при различных условиях. Использование валентности и степени окисления позволяет более точно прогнозировать результаты химических превращений и понять, как изменение окружающей среды может влиять на свойства вещества.
| Элемент | Валентность | Пример соединения |
|---|---|---|
| Кислород | -2 | H2O |
| Водород | +1 | H2O |
| Железо | +2, +3 | FeCl2, FeCl3 |
| Азот | -3, +3, +5 | NH3, NO2, NO3 |
Приведенная таблица демонстрирует примеры различных валентностей для некоторых элементов и соответствующих соединений. Знание валентности и степени окисления помогает ученым и химикам изучать и предсказывать свойства вещества, а также разрабатывать новые материалы и лекарственные препараты.