Амфотерность – это способность вещества проявлять свойства как кислоты, так и основания. Она является одним из важных явлений в химии и помогает понять поведение различных веществ в реакциях.
Основной показатель амфотерности – реакция вещества с кислотой и основанием. В результате взаимодействия с кислотами амфотерное вещество может принять на себя протон и выступать в роли основания. При реакции с основаниями, вещество может отдать протон и проявить свойства кислоты. Таким образом, амфотерные вещества могут действовать как и кислоты, и основания, в зависимости от условий реакции.
Примерами амфотерных оксидов могут служить оксиды металлов, таких как алюминий, цинк и свинец. Например, алюминий оксид (Al2O3), у которого заряд алюминия равен +3, может реагировать и с кислотами, и с основаниями. При реакции с кислотами он принимает на себя протон и проявляет свойства основания, а при реакции с основаниями отдает протон и действует как кислота.
Подобные свойства амфотерности проявляют и другие оксиды металлов, такие как цинковый оксид (ZnO) и свинцовый оксид (PbO). Именно благодаря своей амфотерности эти вещества могут реагировать с различными соединениями и принимать участие в разнообразных химических реакциях.
Что такое амфотерность и когда она проявляется?

Амфотерные вещества могут проявлять амфотерность в растворе. В качестве амфотерных оксидов могут выступать некоторые металлы, кислороды и неметаллы. Например, оксиды алюминия (Al2O3), цинка (ZnO), свинца (PbO) и некоторые другие обладают амфотерными свойствами.
Амфотерность оксидов проявляется в их способности взаимодействовать как с кислотами (проявлять основные свойства), так и с основаниями (проявлять кислотные свойства). Например, амфотерный оксид алюминия, Al2O3, может реагировать как с щелочью, образуя алюминаты, так и с кислотой, образуя алюминийсодержащие соли.
Таким образом, амфотерность является особенностью ряда веществ, позволяющей им выступать как кислоты и как основания в зависимости от условий реакции.
Реакция среды на амфотерные соединения

Амфотерные соединения могут проявлять свои свойства только в определенной реакции среды. Реакция среды на эти соединения может быть различной в зависимости от ее характера: кислотного или щелочного.
В кислотной среде амфотерные соединения проявляют свои основные свойства, т.е. они действуют как основания. Они способны принимать протоны (H+) от кислоты и образовывать соли. Например, оксид алюминия (Al2O3) в кислотной среде реагирует с водой следующим образом:
Al2O3 + 6H+ → 2Al3+ + 3H2O
В щелочной среде амфотерные соединения проявляют свои кислотные свойства, т.е. они действуют как кислоты. Они способны отдавать протоны (H+) щелочам и образовывать соли. Например, оксид алюминия (Al2O3) в щелочной среде реагирует с гидроксидом натрия (NaOH) следующим образом:
Al2O3 + 6OH- → 2Al(OH)4-
Таким образом, реакция среды на амфотерные соединения может изменяться в зависимости от кислотности или щелочности этой среды. Эти свойства делают амфотерные соединения уникальными и широко используемыми в различных химических процессах и реакциях.
Амфотерные оксиды: их значение и примеры
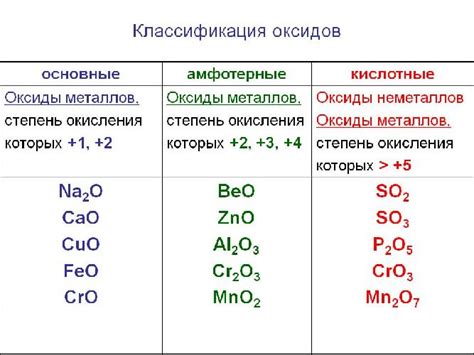
Одним из примеров амфотерных оксидов является оксид алюминия (Al2O3), который может реагировать как с кислотами, так и с щелочами. Он является основной составной частью глины и используется в производстве керамики, стекла и алюминиевых сплавов.
Еще одним примером амфотерного оксида является оксид цинка (ZnO). Он обладает как кислотными, так и щелочными свойствами и широко применяется в производстве резиновых изделий, косметики, лекарственных препаратов и электронных компонентов.
Оксид свинца (PbO) также является амфотерным оксидом. Он используется в производстве стекла, керамики, аккумуляторов и пигментов.
Другие примеры амфотерных оксидов включают оксиды железа (Fe2O3), меди (CuO) и никеля (NiO).
Понимание амфотерности и примеров амфотерных оксидов имеет большое значение в химии и промышленности. Эти свойства позволяют создавать новые материалы и проводить различные реакции, что способствует развитию различных отраслей науки и технологии.
Амфотерность металлов в реакциях с кислотами и щелочами

Многие металлы обладают свойством амфотерности, то есть способностью проявлять кислотные и щелочные свойства в реакциях с кислотами и щелочами соответственно.
Когда металл вступает в реакцию с кислотой, он может выступать в качестве основания, принимая на себя протон от кислоты. Такие реакции приводят к образованию соли и выделению водорода. Например, алюминий при реакции с соляной кислотой образует алюминий хлорид и выделяет молекулы водорода:
- Al + HCl → AlCl3 + H2
С другой стороны, металл может проявить щелочные свойства в реакции с щелочью, отдавая свой протон и образуя ион металла. Например, цинк при реакции с гидроксидом натрия образует натрий цинкат и выделяет молекулы воды:
- Zn + 2NaOH → Na2ZnO2 + H2O
Таким образом, амфотерность металлов определяется их способностью взаимодействовать с кислотами и щелочами и принимать на себя или отдавать протоны. Это свойство имеет важное значение в химической промышленности и позволяет использовать амфотерные металлы в различных процессах и реакциях.
Химические свойства амфотерных оксидов

Амфотерные оксиды обладают способностью реагировать как с кислотами, так и с щелочами. Это свойство определяется наличием в структуре оксида ионов, способных как принимать, так и отдавать протоны (H+). Таким образом, амфотерные оксиды могут проявлять и кислотные, и щелочные свойства в реакциях с различными соединениями.
Взаимодействие амфотерных оксидов с кислотами приводит к образованию солей и воды. Например, оксид алюминия (Al2O3) может реагировать с соляной кислотой (HCl) следующим образом:
| Реагенты | Продукты |
|---|---|
| Al2O3 + 6 HCl | 2 AlCl3 + 3 H2O |
С другой стороны, взаимодействие амфотерных оксидов с щелочами приводит к образованию солей и воды. Например, оксид цинка (ZnO) может реагировать с натриевым гидроксидом (NaOH) следующим образом:
| Реагенты | Продукты |
|---|---|
| ZnO + 2 NaOH | Na2ZnO2 + H2O |
Таким образом, амфотерные оксиды демонстрируют разнообразные химические свойства и могут вступать в реакции с разными реагентами, проявляя кислотные или щелочные свойства в зависимости от условий реакции.