В химии аллотропные видоизменения – это явление, при котором элементы могут существовать в различных геометрических или химических формах, называемых модификациями. Эти модификации обладают различными физическими и химическими свойствами, несмотря на одинаковый химический состав.
Примером аллотропных видоизменений может служить углерод. В природе углерод встречается в трех основных модификациях: алмаз, графит и фуллерен. Алмаз обладает твердым, хрупким и прозрачным свойством, графит – мягким, черным и проводящим ток, а фуллерен – сферической структурой, обладающей высокой стабильностью.
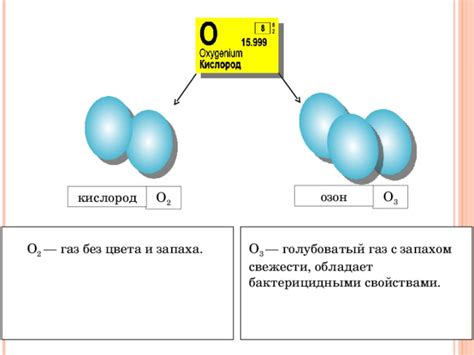
Аллотропные видоизменения также характерны для других химических элементов, таких как кислород, сера и фосфор. Кислород может существовать в виде двух основных модификаций: озона и кислорода. Озон является сильным окислителем и используется в медицинской и промышленной сферах, тогда как кислород является жизненно важным для дыхания организмов.
Аллотропные видоизменения: определение, свойства и примеры

Аллотропные морфы могут отличаться физическими и химическими свойствамы, такими как плотность, твердость, теплопроводность, способность к химическим реакциям и т.д.
Некоторые примеры аллотропных изменений включают:
- Кислород:
- Озон (O3), который обладает сильным запахом и является окислителем.
- Диатомический кислород (O2), который является беззапахным газом и является необходимым для дыхания.
- Алмаз, который обладает кристаллической структурой и является одним из самых твердых известных материалов.
- Графит, который имеет слоистую структуру и является мягким и хорошим проводником электричества.
- Фуллерены, которые представляют собой молекулы углерода в виде полых сферических структур.
- Белый фосфор (P4), который является желтоватой, мягкой и ядовитой вещество.
- Красный фосфор, который является более стабильной и менее токсичной формой фосфора, используемой в зажигательных шишках.
Изучение аллотропных видоизменений важно для понимания свойств и применения химических элементов в различных областях науки и промышленности.
Что такое аллотропные видоизменения
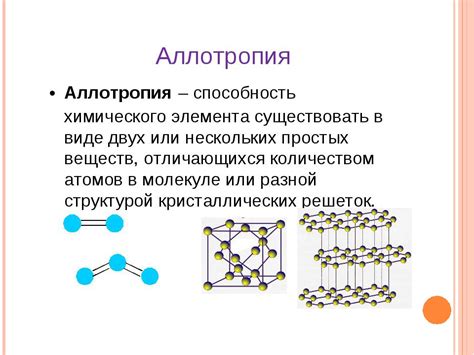
В химии термином "аллотропные видоизменения" обозначается явление, при котором определенное химическое вещество может существовать в нескольких различных структурных формах, называемых аллотропными модификациями. Эти модификации отличаются друг от друга атомной или молекулярной структурой, а следовательно, и свойствами.
Аллотропные видоизменения могут приводить к существенным изменениям в физических и химических свойствах вещества. Например, различные аллотропные формы одного химического элемента могут иметь различную плотность, температуру плавления, твердость, электропроводность и т. д. Аллотропные модификации также могут иметь различную степень реакционной активности и способность образовывать соединения с другими веществами.
Примерами аллотропных видоизменений являются углерод и кислород. Углерод, например, может существовать в различных формах, таких как алмаз, графит, углеродное волокно или фуллерены. Каждая из этих аллотропных модификаций обладает своими уникальными свойствами и находит широкое применение в различных отраслях промышленности и науке.
Аллотропные видоизменения также хорошо известны для кислорода. Например, обычный кислород, используемый для дыхания, является двуатомным газом (O2). Однако кислород также может существовать в трехатомной форме, известной как озон (O3). Озон обладает сильным окислительным действием и используется в качестве дезинфицирующего и очищающего средства.
| Примеры аллотропных видоизменений | Химическое вещество | Аллотропные модификации |
|---|---|---|
| Углерод | C | алмаз, графит, углеродное волокно, фуллерены |
| Кислород | O | О2, О3 (озон) |
Определение аллотропных видоизменений

Переход из одного аллотропа в другой может происходить под воздействием различных условий, таких как температура, давление или наличие катализаторов. Аллотропные видоизменения широко распространены в природе, и многие химические элементы обладают несколькими аллотропными формами.
Примеры аллотропных видоизменений включают углерод, который может существовать в форме алмаза, графита или фуллерена. Другой пример - кислород, который может существовать в форме молекулярного кислорода (O2) или озона (O3).
Аллотропные формы обычно имеют различные физические и химические свойства. Например, алмаз является самым твердым известным материалом, тогда как графит обладает смазочными свойствами и используется в карандашах.
Свойства аллотропных видоизменений

1. Различная структура: Аллотропные видоизменения обладают различной кристаллической или аморфной структурой. Это означает, что атомы вещества могут быть организованы по-разному, что приводит к различным свойствам и поведению материала.
2. Разные физические свойства: Видоизменения имеют разные физические свойства, такие как плотность, твердость, точка плавления и кипения, упругость и т. д. Свойства могут зависеть от конкретной структуры или агрегатного состояния вещества.
3. Различное химическое поведение: Видоизменения могут проявлять различное химическое поведение, что обусловлено различной организацией атомов. Например, одно аллотропное видоизменение может быть более реакционноспособным, чем другое, что может привести к различию в его роль и применении в химических процессах.
4. Уникальные физические свойства: Некоторые аллотропные видоизменения обладают уникальными физическими свойствами, которые делают их полезными в различных областях. Например, углеродные аллотропные видоизменения - алмаз и графен - имеют разные свойства, но оба обладают высокой прочностью и проводимостью, что делает их важными материалами в различных технологиях.
5. Изменчивость свойств: Аллотропные видоизменения могут изменять свои свойства при изменении условий окружающей среды, таких как температура и давление. Например, аллотропное видоизменение кислорода может быть в форме кислородных молекул (O2) при нормальных условиях, но при высоких температурах может быть в форме кислородного атома (O).
6. Влияние на свойства материалов: Присутствие аллотропных видоизменений может значительно повлиять на свойства материалов. Например, добавление малого количества аллотропного варианта другого элемента может изменить прочность или другие характеристики материала.
Примеры аллотропных видоизменений

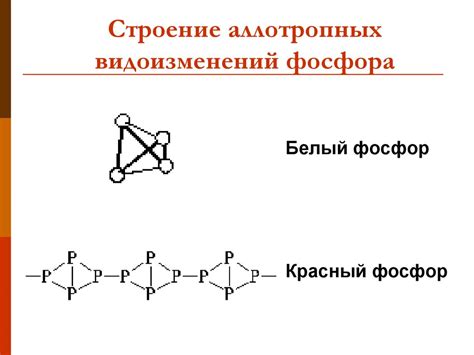
Фосфор: Фосфор также обладает несколькими видами аллотропов, включая белый, красный и черный фосфор. Белый фосфор представляет собой молекулы, состоящие из четырех атомов фосфора, которые образуют призму. Он является очень реактивным, самовозгорающимся материалом при комнатной температуре. Красный фосфор имеет полимерную структуру и стабилен, не самовозгорается. Черный фосфор отличается от всех остальных аллотропов фосфора тем, что его структура напоминает графит. Он обладает полупроводниковыми свойствами и применяется в электронике.
Кислород: Кислород, характерный для нашей атмосферы, представляет собой аллотропный видоизменение, который называется диоксидом кислорода, или O2. Однако в условиях высокого давления и температуры кислород может приобрести другую структуру и состояние, становясь аллотропом, известным как озон, или O3. Озон имеет отличные от диоксида кислорода свойства и оказывает влияние на живой мир, находясь в стратосфере в виде озонового слоя.
Фосфаты: Еще одним примером аллотропного видоизменения являются фосфаты, как ортофосфаты и пирофосфаты. Они представляют собой различные формы фосфорной кислоты и играют важную роль в многих биологических процессах, включая обмен веществ и передачу энергии.
Аллотропные видоизменения предоставляют уникальные свойства и химические реакции каждому аллотропу, что делает их значимыми и интересными для исследования и применения в различных областях науки и промышленности.
Аллотропия и химические реакции
Аллотропия, как видоизменение одного и того же элемента при различных условиях, существенно влияет на его способность к химическим реакциям. При аллотропных изменениях, обусловленных различием в структуре атомов или молекул, часто наблюдаются существенные изменения в химических свойствах вещества.
Процессы, происходящие при химических реакциях, зависят от структуры и особенностей аллотропных форм элементов.
Например, углерод может существовать в нескольких аллотропных формах, таких как алмаз, графит, аморфный (стекловидный) углерод. В зависимости от структуры и связей между атомами, аллотропные формы углерода обладают различными свойствами и подвержены различным химическим реакциям.
| Аллотропное вещество | Химические реакции |
|---|---|
| Алмаз | Стабилен при высоких температурах и давлениях. Не реагирует с большинством химических веществ, не подвержен окислению. |
| Графит | Реагирует с окислителями и некоторыми химическими веществами, образует соединения. |
| Аморфный углерод | Обладает абсорбционной способностью, может адсорбировать различные газы и химические соединения. |
Аналогичные примеры можно увидеть и в других элементах, таких как кислород и сера. Все эти примеры подтверждают влияние аллотропных изменений на химические реакции и позволяют получить и использовать различные соединения на основе одного элемента.
Значение аллотропных видоизменений в научных и технических областях
Аллотропные видоизменения обладают различными физическими и химическими свойствами. Например, карбон может существовать в виде алмаза, графита и фуллерена, каждая из которых имеет свою уникальную кристаллическую структуру и свойства. Алмаз является самым твердым материалом, графит обладает смазывающими свойствами, а фуллерен обладает высокой степенью химической реактивности.
В научных исследованиях аллотропные видоизменения играют важную роль при изучении свойств различных материалов. Так, например, аллотропные модификации углерода используются в нанотехнологиях и разработке новых материалов с уникальными свойствами. Нанотрубки, полученные из углеродных аллотропов, имеют высокую прочность и проводимость, что делает их полезными в электронике и энергетике.
Технические применения аллотропных видоизменений также находятся во многих областях промышленности. Например, графен, двумерный материал, состоящий из одного атомного слоя углерода, обладает уникальными свойствами, такими как высокая теплопроводность и электропроводность. Использование графена может привести к разработке новых электронных устройств, более эффективных образцов солнечных панелей и других инновационных технологий.
Таким образом, аллотропные видоизменения играют важную роль в научных и технических областях, позволяя создавать новые материалы с уникальными свойствами и применять их в различных технологиях. Это открывает возможности для развития новых областей науки и промышленности, способствуя технологическому прогрессу.