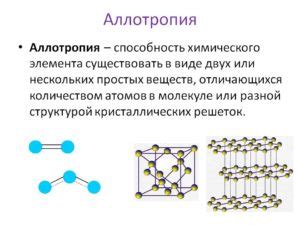
Аллотропия – это феномен в химии, связанный с существованием одного и того же химического элемента в различных структурных формах, которые обладают различными свойствами. Такие формы элемента называют аллотропными модификациями. Аллотропия может проявляться в различных свойствах, таких как цвет, твёрдость, плотность и т.д.
Аллотропия является фундаментальным понятием в химии и исследуется в рамках разных областей науки, включая синтез и изучение аллотропных модификаций элементов. Образование аллотропных форм может быть вызвано различными факторами, такими как давление, температура или химические реакции.
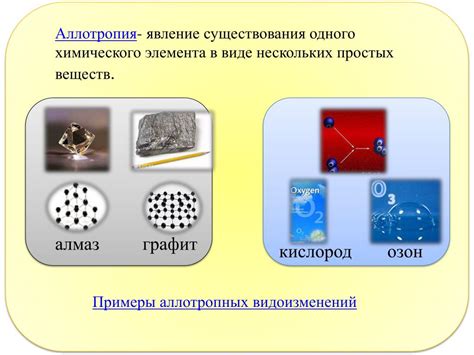
Примерами аллотрории могут служить такие химические элементы, как кислород, графит, фосфор и сера. Например, кислород может существовать в двух аллотропных формах: молекулярный кислород (O2), который обладает свойствами окислителя, и озон (O3), который является сильным окислителем. Графит и алмаз – оба являются аллотропными формами углерода, однако обладают различными структурами и свойствами.
Что такое аллотропия в химии

Примером аллотропии является кислород, который может существовать в двух аллотропных формах - молекулярном кислороде (O2) и озоне (O3). Молекулярный кислород представляет собой двухатомную молекулу с двумя одинарными связями между атомами кислорода. Озон состоит из трех атомов кислорода, в котором один атом образует две двойные связи с двумя другими атомами.
Другим примером аллотропии является углерод, который может образовывать несколько аллотропных модификаций, включая алмаз, графит и фуллерены. Алмаз представляет собой трехмерную кристаллическую структуру углерода, где каждый атом углерода связан с четырьмя соседними атомами через ковалентные связи. Графит имеет слоистую структуру, где атомы углерода связаны между собой в двумерных слоях, а слои удерживаются слабыми ван-дер-ваальсовыми силами. Фуллерены - это молекулы углерода в форме полых сфер, состоящих из пяти- и шестиугольных атомных колец.
Аллотропия является важным явлением в химии, так как аллотропные модификации одного и того же элемента могут иметь различные свойства и применения. Например, алмаз является самым твердым известным материалом и используется в ювелирном и промышленном производстве, графит служит в качестве материала для карандашей и в производстве электродов, а фуллерены обладают уникальными электронными и оптическими свойствами и находят применение в нанотехнологии и медицине.
| Химический элемент | Аллотропные модификации |
|---|---|
| Углерод | Алмаз, графит, фуллерены |
| Кислород | Молекулярный кислород, озон |
| Фосфор | Белый фосфор, красный фосфор, черный фосфор |
Основные особенности аллотропии

Основные особенности аллотропии следующие:
1. Различные формы аллотропных веществ имеют разную кристаллическую структуру и атомную решетку. Это приводит к различным свойствам, таким как плотность, твердость и плавление.
2. Аллотропные формы могут быть стабильными при различных температурах и давлениях. Например, карбон имеет несколько аллотропных форм, таких как алмаз, графит и фуллерены, которые стабильны при различных условиях.
3. Высокая реактивность аллотропных форм может приводить к разным химическим реакциям и свойствам. Например, кислород может существовать в виде озона, который является сильным окислителем, или в виде молекулярного кислорода, который неактивен и необходим для дыхания.
4. Аллотропия может быть важной для различных применений в науке и промышленности. Например, алмаз используется в ювелирном деле и для изготовления режущих инструментов, а графит - в карандашах и в производстве электродов.
В итоге, аллотропия является важным явлением в химии, которое позволяет различным формам вещества существовать и проявлять различные свойства в зависимости от условий окружающей среды.
Аллотропия в химии: исторический обзор

Идея аллотропии в химии появилась в конце XVIII века, когда французский химик Лавуазье заметил, что ряд элементов, таких как углерод и кислород, могут существовать в разных формах, имеющих различные физические и химические свойства.
Первым известным примером аллотропии является кислород. Лавуазье обнаружил, что кислород может существовать в двух основных формах: двухатомном молекулярном кислороде (O2) и одноатомном атомарном кислороде (O). Молекулярный кислород является стабильной формой кислорода, которая составляет около 20% атмосферы Земли, и необходим для дыхания и горения. Атомарный кислород, с другой стороны, более реакционен и используется в различных химических процессах.
Другим примером аллотропии является углерод. Углерод может существовать в нескольких формах, включая алмаз и графит. Алмаз является твердым, прозрачным кристаллическим материалом, обладающим высокой твердостью. Графит, с другой стороны, является мягким, черным материалом, используемым в карандашах. Обе формы углерода состоят из одних и тех же атомов углерода, но их структура различается, что приводит к различным свойствам.
В последующие годы были открыты и исследованы другие примеры аллотропии, такие как фосфор, сера и кремний. Аллотропия играет важную роль в химии и материаловедении, так как разные формы одного элемента имеют различные свойства и могут использоваться в различных промышленных и научных приложениях.
Примеры аллотропии в природе
- Кислород: самые известные формы кислорода – это молекулярный кислород (О2) и озон (О3). Молекулярный кислород является стабильной, безцветной и беззапаховой формой, которая составляет около 20% атмосферного воздуха. Озон, в свою очередь, представляет собой трехатомную форму кислорода и является мощным окислителем.
- Углерод: углерод может образовывать различные аллотропные формы, такие как аморфный углерод, графит и алмаз. Аморфный углерод представляет собой непористое или слабопористое вещество без явно выраженной кристаллической структуры. Графит состоит из слоев атомов углерода, которые легко отслаиваются друг от друга и являются электрически проводящими. Алмаз же является жестким и прозрачным материалом из кристаллической решетки углерода.
- Фосфор: существует несколько форм фосфора, включая белый, красный и черный фосфор. Белый фосфор представляет собой желтовато-белое вещество, которое легко воспламеняется на воздухе. Красный фосфор имеет темно-красный цвет и является стабильной и менее токсичной формой. Черный фосфор, в свою очередь, обладает металлическими свойствами и является самой стабильной формой фосфора при комнатной температуре.
- Сера: существует несколько различных аллотропных модификаций серы, включая ромбическую серу, моноклинную серу и пластинчатую серу. Ромбическая сера, известная также как простая сера, является самой стабильной и наиболее распространенной формой серы. Моноклинная сера обычно образуется при нагревании ромбической серы. Пластинчатая сера представляет собой шестигранник тонких листов, которые могут слоисто соединяться.
Это лишь некоторые примеры аллотропии в природе. Множество элементов и соединений могут образовывать различные аллотропные формы, которые имеют различные свойства и структуры.
Примеры аллотропии в искусственных материалах
Аллотропия, явление присущее не только природным элементам, но также может проявиться и в искусственных материалах. Некоторые искусственные материалы также могут существовать в различных аллотропных формах, в зависимости от условий и методов их производства.
Один из ярких примеров аллотропии в искусственных материалах - карбоноволокно. Этот материал, получаемый из углеродных волокон, может существовать в нескольких формах: аморфной и графитированной. Аморфное карбоноволокно имеет неупорядоченную структуру и обладает высокой прочностью и эластичностью. В то же время, графитированное карбоноволокно имеет упорядоченную структуру и отличается высокой термостойкостью и электропроводимостью.
Еще одним интересным примером аллотропии в искусственных материалах являются искусственные алмазы. Алмазы, полученные в лабораторных условиях, могут иметь различную структуру, в зависимости от способа синтеза. Например, алмазы, полученные методом CVD (химического осаждения из газовой фазы), имеют поликристаллическую структуру, в то время как алмазы, полученные методом HPHT (высокого давления и высокой температуры), имеют однокристаллическую структуру и более близки к природным алмазам.
Таким образом, аллотропия может проявляться и в искусственных материалах, открывая новые возможности для создания материалов с различными свойствами и применениями.
Применение аллотропных форм в промышленности

Аллотропные формы многих элементов имеют ценность и находят широкое применение в различных отраслях промышленности. Ниже представлены несколько примеров:
- Уголь: Существуют различные аллотропные формы угля, такие как антрацит, кокс и битуминозный уголь. Антрацит, например, используется в металлургической промышленности для производства чугуна и сталей. Кокс, в свою очередь, используется в процессе производства стали. Битуминозный уголь применяется в теплоэнергетике для производства электроэнергии.
- Кислород: Кислород может существовать в нескольких аллотропных формах, самой известной из которых является молекулярный кислород (O2). Молекулярный кислород широко применяется в различных отраслях промышленности, таких как медицина, производство стекла и металлургия.
- Фосфор: Фосфор также может существовать в различных аллотропных формах, таких как белый фосфор и красный фосфор. Белый фосфор используется в производстве восков, пластмасс и противогрибковых препаратов. Красный фосфор используется в производстве смазок, красок и пиротехнических изделий.
- Углерод: Углерод может существовать во множестве аллотропных форм, таких как алмаз, графит, фуллерены и углеродные нанотрубки. Алмаз используется в ювелирной промышленности, графит – в производстве линий и электродов, фуллерены и углеродные нанотрубки – в нанотехнологиях и электронике.
- Сера: Сера также имеет несколько аллотропных форм, таких как ромбическая сера и моноклинная сера. Ромбическая сера используется в производстве серной кислоты и удобрений, а моноклинная сера используется в производстве резины и взрывчатых веществ.
Это только некоторые примеры применения аллотропных форм в промышленности. Знание свойств и особенностей каждой аллотропной формы позволяет использовать элементы наиболее эффективно в различных производственных процессах.