Неметаллы - это группа химических элементов, которые обладают определенными особенностями и свойствами. Они отличаются от металлов по своей структуре и поведению в химических реакциях. Неметаллические элементы обычно недолговечны и хрупки, их химическая активность может быть разной.
Одной из основных характеристик неметаллов является их способность к образованию ковалентных связей. При этом электроны одного атома делятся с электронами другого атома, образуя попарные связи или молекулы. Это позволяет неметаллам образовывать различные химические соединения и проявлять свои уникальные свойства.
Неметаллы имеют разнообразные физические и химические свойства, которые делают их полезными и важными в различных областях. Например, кислород, один из самых известных неметаллов, является важным для поддержания жизни на Земле и используется в медицине и промышленности. Углерод является основой органических соединений и имеет широкое применение в производстве пластмасс, удобрений и электроники. Фтор используется в производстве полимеров и применяется в химической промышленности.
Примеры других неметаллических элементов включают азот, серу, фосфор, хлор, бром и йод. Каждый из них обладает своими особыми свойствами и имеет своеобразное влияние на окружающую среду и национальное хозяйство.
Понимание основных характеристик и свойств неметаллов позволяет ученым и исследователям применять их в различных областях и разрабатывать новые технологии и материалы, необходимые для нашего современного общества.
Неметаллические свойства: определение и классификация

Немиталы можно условно разделить на несколько классов:
- Диагенные неметаллы: это инертные газы, такие как гелий и неон, которые обычно неполные внешние энергетические уровни
- Амфотерные неметаллы: это неметаллы, которые могут иметь и противоположное, металлическое свойство, например, бор и арсен
- Полуметаллы: это элементы, которые обладают одновременно и металлическими, и неметаллическими свойствами, например, германий и антимон
- Активные неметаллы: это элементы, которые проявляют большую активность в химических реакциях, например, флуор и кислород
Каждый из этих классов неметаллов имеет свои уникальные свойства и химические реакции, что делает их важными составляющими многих химических процессов и соединений.
Химическая связь и неметаллические элементы

Неметаллические элементы - это элементы, которые образуют атомы с непроводящими электрический ток связями. Они обычно имеют высокую электроотрицательность и способны образовывать ковалентные связи. Примеры неметаллических элементов включают в себя водород, кислород, азот, фтор, хлор и многие другие.
Одной из основных особенностей неметаллов является их способность образовывать многочисленные связи с другими атомами. Например, молекула кислорода (O2) состоит из двух атомов кислорода, соединенных двойной связью. Азотная молекула (N2) имеет тройную связь между двумя атомами азота.
Неметаллические элементы также проявляют различные химические свойства в виде кислотности, щелочности или нейтральности. Например, кислородные элементы (кислород, сера) образуют кислоты при сочетании с водородом, тогда как щелочные металлы (натрий, калий) образуют основания.
Неметаллические элементы широко используются в различных областях, таких как промышленность, медицина, энергетика и другие. Например, кислород используется в процессе дыхания и в производстве стали, фтор используется в химической промышленности, азот используется в удобрениях и взрывчатых веществах.
- Примеры неметаллических элементов:
- Кислород (O)
- Азот (N)
- Углерод (C)
- Фосфор (P)
- Сера (S)
- Фтор (F)
- Хлор (Cl)
- Бром (Br)
- Йод (I)
Неметаллические элементы играют ключевую роль в понимании основных принципов химической связи и в создании различных соединений с разнообразными свойствами. Изучение их химических свойств позволяет лучше понять природу материи и использовать эти знания в различных областях науки и технологии.
Физические характеристики неметаллических веществ

Неметаллические вещества отличаются от металлов своими физическими характеристиками. Они имеют низкую плотность, обычно встречаются в форме газа, жидкости или твердого вещества с низкой температурой плавления и кипения.
Среди неметаллов есть как газы, например кислород (O2) и водород (H2), так и жидкости, например бром (Br2) и йод (I2). Большинство неметаллов являются твердыми веществами, такими как сера (S), фосфор (P), углерод (C) и кремний (Si).
Неметаллические вещества обычно обладают непроводимостью электрического тока и тепла, за исключением некоторых исключений, таких как графит, который может проводить электричество. Они также обладают хрупкостью и низкой твердостью, что делает их неподходящими для использования в конструкционных материалах. Они часто образуют хрупкие кристаллические структуры, которые легко разрушаются под действием механического напряжения.
Несмотря на их негативные физические свойства, неметаллы играют важную роль в химической промышленности. Например, кислород используется для поддержки горения, азот используется в производстве удобрений, а углерод является основным компонентом органических соединений.
- Низкая плотность
- Низкая температура плавления и кипения
- Возможность существовать в газообразном, жидком и твердом состоянии
- Непроводимость электричества и тепла (за исключением некоторых исключений)
- Хрупкость и низкая твердость
Осознание этих физических характеристик неметаллических веществ имеет важное значение для понимания их свойств и применений в различных областях науки и технологий.
Химические свойства неметаллов

1. Реакция с кислородом: Неметаллы обладают высокой аффинностью к кислороду и могут сильно вступать в реакцию с ним. При этом они образуют оксиды, которые могут иметь разную степень окисления.
2. Реакция с водородом: Некоторые неметаллы могут реагировать с водородом, образуя газообразные соединения. Например, хлор вступает в реакцию с водородом и образует соляную кислоту.
3. Образование кислот: Многие неметаллы образуют кислоты в реакции с водой. Такие кислоты имеют ряд важных свойств и широко используются в промышленности и научных исследованиях.
4. Электроотрицательность: Неметаллы обладают высокой электроотрицательностью, что означает их способность привлекать электроны во время химических реакций. Это позволяет им образовывать ковалентные связи и обладать избыточными электронами, что делает их неоснователями и хорошими окислителями.
5. Образование бинарных соединений: Неметаллы образуют широкий спектр бинарных соединений с другими элементами. Эти соединения могут быть стабильными или реакционноспособными, и играют важную роль в химической промышленности и технологиях.
Неметаллы являются важными элементами в химии и имеют множество промышленных и научных применений. Изучение и понимание их химических свойств помогает развивать новые материалы, процессы и технологии.
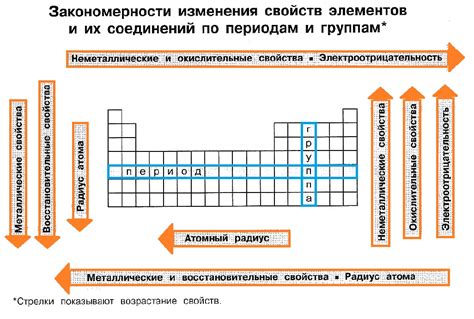
Электроотрицательность и кислотность неметаллов

Электроотрицательность - это способность атома притягивать к себе электроны в химической связи. Чем выше электроотрицательность атома, тем сильнее он притягивает электроны. В таблице электроотрицательностей Менделеева неметаллы обычно располагаются в правой части периодической таблицы, в то время как металлы располагаются в левой ее части.
Неметаллы с высокой электроотрицательностью имеют большую склонность получать электроны и образовывать отрицательно заряженные ионы, что позволяет им вступать в химические реакции в качестве кислотных элементов.
Например, кислород является одним из самых электроотрицательных элементов и встречается в большинстве неметаллических соединений. Вода (H2O) - это пример неметаллического соединения, в котором кислород действует в качестве кислотного элемента.
Кислостью называется способность элемента или соединения отдавать протоны. Неметаллы обычно обладают большей кислотностью по сравнению с металлами. Кислотность неметаллов обусловлена их способностью притягивать электроны и образовывать отрицательно заряженные ионы.
Примеры неметаллов, обладающих высокой кислотностью, включают серу, фосфор, хлор и азот. Они образуют различные соединения, которые проявляют кислотные свойства, такие как серная кислота (H2SO4), фосфорная кислота (H3PO4), хлороводород (HCl) и аммиак (NH3).
Важно отметить, что единственный элемент в периодической таблице, который обладает сразу и металлическими, и неметаллическими свойствами, является германий. Германий имеет металлическую структуру, но обладает высокой электроотрицательностью и может вступать в реакции с металлами и неметаллами.
Реактивность неметаллов и их соединений

Реактивность неметаллов в химии определяется их способностью образовывать химические соединения с другими элементами или соединениями. Неметаллы обычно проявляют высокую реактивность и могут вступать во взаимодействие со многими другими элементами.
Некоторые из наиболее реактивных неметаллов включают галогены, такие как фтор, хлор, бром и йод. Они проявляют сильное окислительное действие и могут образовывать соединения с большинством металлов. Галогены также обладают высокой электроотрицательностью и могут образовывать халогениды с гидроэлементами, такими как водород.
Другой важной группой реактивных неметаллов являются кислород и сера. Они способны образовывать оксиды и серы соответственно при взаимодействии с другими элементами. Кислород также может вступать в реакцию с неорганическими соединениями, образуя кислородные соли (оксиды).
Неметаллы также реагируют с карбоном, образуя соединения, известные как карбиды. Например, карбид кремния (SiC) используется в производстве абразивов и керамики.
Реактивность соединений неметаллов зависит от их химической структуры и типа элементов, с которыми они связаны. Некоторые неметаллические соединения, такие как кислоты, обладают высокой реактивностью и могут вступать в реакцию с основаниями, металлами и другими соединениями.
Другие соединения, такие как органические полимеры, могут быть менее реактивными и обладать стабильной химической структурой. Однако они все равно могут реагировать с определенными веществами, например, с оксидизирующими агентами или сильными кислотами.
Химические примеры неметаллических свойств: кислород
- Окислительные свойства: Кислород является сильным окислителем и способен окислять другие вещества. Например, при сгорании кислород окисляет органические вещества, такие как древесина или углеводороды, образуя диоксид углерода и воду.
- Реакция с металлами: Кислород может реагировать с многими металлами, образуя оксиды металлов. Например, при нагревании меди с кислородом образуется оксид меди (II) - CuO.
- Растворимость в воде: Кислород легко растворяется в воде, образуя растворимый газ - молекулярный кислород (O2). Это позволяет живым организмам, таким как рыбы, дышать под водой.
- Образование кислот: Кислород может соединяться с другими элементами, образуя кислоты. Например, соединение кислорода с водородом приводит к образованию воды, которая также является кислотой по Льюису.
Кислород играет важную роль во многих химических реакциях и является необходимым для поддержания жизни на Земле. Он является ключевым компонентом воздуха и широко используется в промышленности и медицине.
Химические примеры неметаллических свойств: сера
1. Воспламеняемость: Сера может гореть с ярким сине-голубым пламенем при воздействии открытого огня. Это свойство делает ее полезной в различных приложениях, включая производство порошковых огнетушителей.
2. Кислотность: Сера может растворяться в воде, образуя серную кислоту. Серная кислота широко используется в промышленности, в том числе для производства удобрений и очистки металлов.
3. Антисептические свойства: Сера имеет антисептические свойства и может быть использована в медицине для борьбы с бактериями и инфекциями.
4. Вулканическая активность: Сера встречается в большом количестве на поверхности Земли в районах вулканической активности. Ее химические свойства играют важную роль в формировании вулканических газов и лавы.
5. Производство серной кислоты: Сера является важным сырьем для производства серной кислоты, которая широко используется в процессах, таких как производство бумаги и текстиля, очистка металлов и производство удобрений.
Все эти свойства делают серу важным элементом в различных отраслях промышленности и науки.
Химические примеры неметаллических свойств: азот
- Неактивность: Азот является химически инертным газом. Он не реагирует с большинством других веществ при комнатной температуре и давлении.
- Незаметный цвет и запах: Азот - бесцветный и без запаха газ. Это делает его незаметным и невесомым для обычного человека.
- Вулканическая активность и азотные оксиды: Вулканы могут выбрасывать большие объемы азота и азотных оксидов, что способствует образованию атмосферного загрязнения и анионов в почве.
- Участие в образовании жизненно важных соединений: Азот является основным компонентом белка, аминокислот и нуклеиновых кислот, которые составляют генетическую информацию организмов.
- Аммиачное удобрение: Аммиак, получаемый при промышленном синтезе азота, широко используется как удобрение для повышения почвенной плодородности.
Эти примеры наглядно демонстрируют значимость азота как неметалла в различных сферах - от химической промышленности до биологии.